题目内容
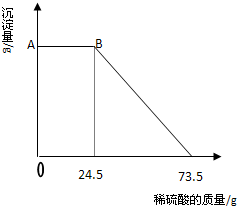
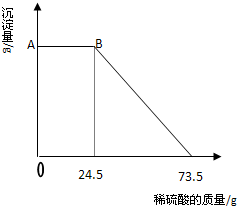 某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.
某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.
(1)写出AB段发生反应的化学方程式________.
(2)计算A点的纵坐标________.
(3)求该固体混合物中NaOH的质量.
解:(1)物质之间的反应有MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,2NaOH+H2SO4=Na2SO4+H2O,Mg(OH)2+H2SO4═MgSO4+2H2O;由图示数据可知,开始加入硫酸至24.5g时,沉淀没有减少,是因为硫酸在与氢氧化钠反应,故反应的化学方程式为:2NaOH+H2SO4=Na2SO4+H2O;
(2)由图示数据可知,与氢氧化镁沉淀反应的硫酸溶液的质量为:73.5g-24.5g=49g,
设参与反应的沉淀氢氧化镁的质量为x,
Mg(OH)2+H2SO4═MgSO4+2H2O
58 98
x 9.8g
 ═
═
解之得:x=5.8g;故A点的纵坐标为5.8.
(3)设参与反应的MgSO4的质量为y,
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,
120 58
y 5.8g
 ═
═
解之得:y=12g;
所以氢氧化钠的质量为24g-12g=12g,
答:固体混合物中NaOH的质量为12g.
分析:物质之间的反应有MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,2NaOH+H2SO4=Na2SO4+H2O,Mg(OH)2+H2SO4═MgSO4+2H2O;由图示数据可知,开始加入硫酸至24.5g时,沉淀没有减少,是因为硫酸在与氢氧化钠反应,B段以后才是硫酸与氢氧化镁沉淀反应的质量.利用氢氧化镁与硫酸反应的化学方程式,列出比例式,就可计算出MgSO4和NaOH反应生成沉淀的质量即A点的纵坐标;然后再利用MgSO4和NaOH反应的化学方程式,列出比例式,计算出固体物质中MgSO4的质量;然后NaOH的质量即可求出.
点评:本题主要考查学生利用化学方程式进行计算的能力.本题所涉化学反应较多,解答时需认真分析图示数据和已知条件以及物质间反应的情况,才能正确解答.
(2)由图示数据可知,与氢氧化镁沉淀反应的硫酸溶液的质量为:73.5g-24.5g=49g,
设参与反应的沉淀氢氧化镁的质量为x,
Mg(OH)2+H2SO4═MgSO4+2H2O
58 98
x 9.8g
 ═
═
解之得:x=5.8g;故A点的纵坐标为5.8.
(3)设参与反应的MgSO4的质量为y,
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,
120 58
y 5.8g
 ═
═
解之得:y=12g;
所以氢氧化钠的质量为24g-12g=12g,
答:固体混合物中NaOH的质量为12g.
分析:物质之间的反应有MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,2NaOH+H2SO4=Na2SO4+H2O,Mg(OH)2+H2SO4═MgSO4+2H2O;由图示数据可知,开始加入硫酸至24.5g时,沉淀没有减少,是因为硫酸在与氢氧化钠反应,B段以后才是硫酸与氢氧化镁沉淀反应的质量.利用氢氧化镁与硫酸反应的化学方程式,列出比例式,就可计算出MgSO4和NaOH反应生成沉淀的质量即A点的纵坐标;然后再利用MgSO4和NaOH反应的化学方程式,列出比例式,计算出固体物质中MgSO4的质量;然后NaOH的质量即可求出.
点评:本题主要考查学生利用化学方程式进行计算的能力.本题所涉化学反应较多,解答时需认真分析图示数据和已知条件以及物质间反应的情况,才能正确解答.

练习册系列答案
相关题目

 某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.
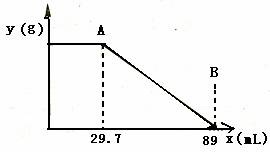
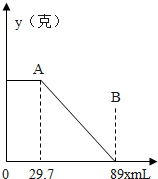
某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.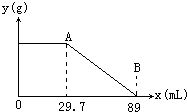 某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g?mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位;g)有如图所示的关系,求该固体混合物中NaOH、MgSO4的质量各为多少克?
某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g?mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位;g)有如图所示的关系,求该固体混合物中NaOH、MgSO4的质量各为多少克?