题目内容
某固体物质由MgSO4和NaOH组成,取24克该固体混合物溶于水后,向所得的混合物中逐渐加入15%的硫酸(密度为1.1g/mL),发现沉淀量y与加入的硫酸的体积x有如图的关系.求该固体中MgSO4、NaOH的质量各为多少?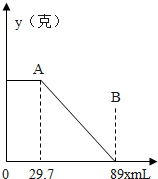
分析:物质之间的反应有2NaOH+H2SO4=Na2SO4+H2O,MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,Mg(OH)2+H2SO4═MgSO4+2H2O;由图示数据可知,开始加入硫酸至29.7mL时,沉淀没有减少,是因为硫酸在与氢氧化钠反应,A~B断才是硫酸与氢氧化镁沉淀反应的体积.利用氢氧化镁与硫酸反应的化学方程式,列出比例式,就可计算出MgSO4和NaOH反应生成沉淀的质量;然后再利用MgSO4和NaOH反应的化学方程式,列出比例式,计算出固体物质中MgSO4的质量和参与反应的氢氧化钠的质量;然后再利用氢氧化钠与硫酸反应的化学方程式,列出比例式,计算出此反应中氢氧化钠的质量,两者之和就是固体物质中NaOH的质量.(或者直接用固体质量-该固体中MgSO4的质量=NaOH的质量计算更简便.)
解答:解:①由图示数据可知,与氢氧化镁沉淀反应的硫酸溶液的体积为:89mL-29.7mL=59.3mL,则H2SO4质量为:59.3mL×1.1g/mL×15%≈9.8g,
设参与反应的沉淀氢氧化镁的质量为x,
Mg(OH)2+H2SO4═MgSO4+2H2O
58 98
x 9.8g
∴
=
,
解之得:x=
=5.8g;
②设参与反应的MgSO4的质量为y,NaOH的质量为z,
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
120 80 58
y z 5.8g
∴
=
,
=
解之得:y=
=12g;
z=
=8g;
③由图示可知,与氢氧化钠反应的硫酸溶液的体积为29.7mL,则其中H2SO4的质量为:29.7mL×1.1g/mL×15%=4.9g,
设与硫酸反应的氢氧化钠的质量为r,
2NaOH+H2SO4=Na2SO4+H2O
80 98
r 4.9g
∴
=
,
解之得:r=
=4g;
则该固体中NaOH的质量=8g+4g=12g.
答:该固体中MgSO4的质量为12g;NaOH的质量为12g.
(或者还可以用固体质量-该固体中MgSO4的质量=NaOH的质量计算更简便.)
设参与反应的沉淀氢氧化镁的质量为x,
Mg(OH)2+H2SO4═MgSO4+2H2O
58 98
x 9.8g
∴
| 58 |
| 98 |
| x |
| 9.8g |
解之得:x=
| 9.8g×58 |
| 98 |
②设参与反应的MgSO4的质量为y,NaOH的质量为z,
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
120 80 58
y z 5.8g
∴
| 120 |
| 58 |
| y |
| 5.8g |
| 80 |
| 58 |
| z |
| 5.8g |
解之得:y=
| 5.8g×120 |
| 58 |
z=
| 5.8g×80 |
| 58 |
③由图示可知,与氢氧化钠反应的硫酸溶液的体积为29.7mL,则其中H2SO4的质量为:29.7mL×1.1g/mL×15%=4.9g,
设与硫酸反应的氢氧化钠的质量为r,
2NaOH+H2SO4=Na2SO4+H2O
80 98
r 4.9g
∴
| 80 |
| 98 |
| r |
| 4.9g |
解之得:r=
| 4.9g×80 |
| 98 |
则该固体中NaOH的质量=8g+4g=12g.
答:该固体中MgSO4的质量为12g;NaOH的质量为12g.
(或者还可以用固体质量-该固体中MgSO4的质量=NaOH的质量计算更简便.)
点评:本题主要考查学生利用化学方程式进行计算的能力.本题所涉化学反应较多,解答时需认真分析图示数据和已知条件以及物质间反应的情况,才能正确解答.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
相关题目

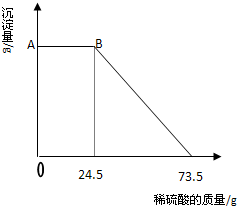 某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.
某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.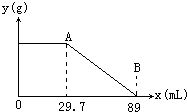 某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g?mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位;g)有如图所示的关系,求该固体混合物中NaOH、MgSO4的质量各为多少克?
某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g?mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位;g)有如图所示的关系,求该固体混合物中NaOH、MgSO4的质量各为多少克?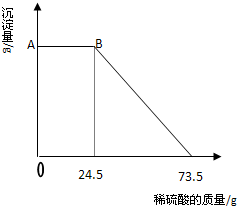 某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.
某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.