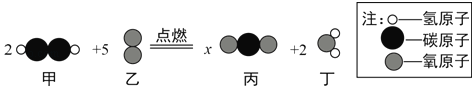
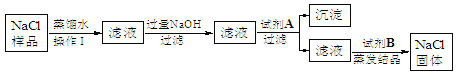
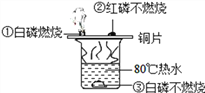
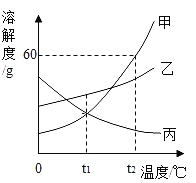
题目内容
【题目】鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中碳酸钙的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除碳酸钙外的其他成分不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所有盐酸刚好消耗了加入量的一半.试计算:
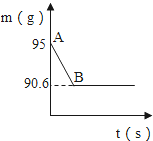
(1)生成二氧化碳的质量_____.
(2)所用稀盐酸中溶质的质量分数_____.
【答案】4.4g 18.25%
【解析】
碳酸钙与盐酸反应放出二氧化碳使烧杯中的反应剩余物质量逐渐减小,根据质量守恒定律,完全反应前后的质量差即为反应放出气体二氧化碳的质量;根据生成二氧化碳的质量,利用反应的化学方程式,计算参加反应的碳酸钙的质量、盐酸的质量即可解决问题。
(1)反应生成CO2的质量为95g-90.6g=4.4g。
(2)设反应消耗的HCl的质量为x,
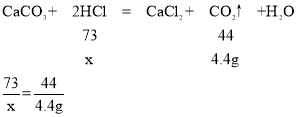
解得 x=7.3g
因为盐酸刚好消耗了加入量的一半
所以80g稀盐酸中溶质质量=7.3g×2=14.6g
盐酸溶液中溶质的质量分数为:![]() ×100%=18.25%。
×100%=18.25%。
答:(1)生成二氧化碳的质量为4.4g;
(2)所用稀盐酸中溶质的质量分数为18.25%。

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目