题目内容
【题目】为了探究碳酸钙与稀盐酸的接触面积对反应速率的影响,某化学兴趣小组的同学进行了如下实验。
(进行实验)按图所示的装置进行实验,倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,测定瓶内的气压随时间的变化如图所示。
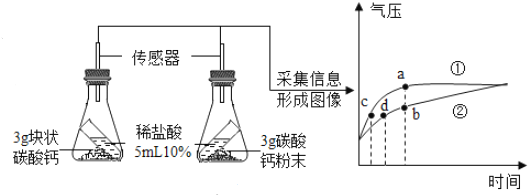
(实验分析)(1)碳酸钙与稀盐酸反应的化学方程式为_____。
(2)对比分析![]() 、
、![]() 两点可知,______曲线表示粉末状碳酸钙和稀盐酸反应;对比分析
两点可知,______曲线表示粉末状碳酸钙和稀盐酸反应;对比分析![]() 、
、![]() 两点可知,相同气压时,_____(选填“粉末状”或“块状”)碳酸钙与稀盐酸反应速率更快。
两点可知,相同气压时,_____(选填“粉末状”或“块状”)碳酸钙与稀盐酸反应速率更快。
(3)由图可知,碳酸钙粉末产生的CO2____(选填“大于”“小于”或“等于”)块状碳酸钙产生的CO2。
(实验结论)碳酸钙与稀盐酸的接触面积越大,反应速率越快。
(4)还有哪些因素影响碳酸钙与稀盐酸反应的快慢,请提出猜想,并设计实验方案进行验证。
猜想:______;
实验方案______。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ a 粉末状 等于 所用盐酸的质量分数影响碳酸钙与稀盐酸反应的快慢 向两只锥形瓶内各加入3g块状碳酸钙,再向一只锥形瓶内加入5mL10%的稀盐酸,向另一只锥形瓶内加入5mL5%的稀盐酸,测量产生等量二氧化碳气体所需的时间
【解析】
(1)碳酸钙与稀盐酸反应生成氯化钙水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)对比分析![]() 、
、![]() 两点可知,曲线a单位时间内气压大,说明单位时间内产生的气体多,反应速率快,故a曲线表示粉末状碳酸钙和稀盐酸反应;对比分析c、d两点可知,相同气压时,c所需的时间短,说明单位时间内产生的气体多,反应速率快,故粉末状碳酸钙与稀盐酸反应速率更快;
两点可知,曲线a单位时间内气压大,说明单位时间内产生的气体多,反应速率快,故a曲线表示粉末状碳酸钙和稀盐酸反应;对比分析c、d两点可知,相同气压时,c所需的时间短,说明单位时间内产生的气体多,反应速率快,故粉末状碳酸钙与稀盐酸反应速率更快;
(3)由图可知,最终曲线a、b的气压相等,说明最终产生二氧化碳的量相等;
(4)猜想:所用盐酸的质量分数影响碳酸钙与稀盐酸反应的快慢;
实验方案:向两只锥形瓶内各加入3g块状碳酸钙,再向一只锥形瓶内加入5mL10%的稀盐酸,向另一只锥形瓶内加入5mL5%的稀盐酸,测量产生等量二氧化碳气体所需的时间。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案