题目内容
【题目】已知:2CO2+2Na2O2═2Na2CO3+O2.在密闭容器中,将 6.6g CO2 与一定量的 Na2O2固体充分反应后,气体变为3.8g.下列说法正确的是( )
A. 3.8g气体全部是O2
B. 剩余CO2的质量是2.2g
C. 反应后的固体是混合物
D. 生成Na2CO3的质量是15.9g
【答案】B
【解析】
设:参加反应二氧化碳的质量为x,参加反应过氧化钠的质量为y,生成碳酸钠的质量为z,生成氧气的质量为m。
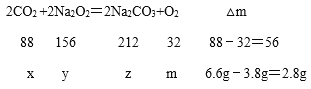
![]()
解得:x=4.4g,y=7.8g,z=10.6g,m=1.6g
由计算结果可知,
A、剩下的3.8g气体有二氧化碳2.2g,氧气1.6g,故A错误;
B、剩下的3.8g气体有二氧化碳2.2g,故B正确;
C、反应中二氧化碳过量,Na2O2固体已反应完全,反应后的固体只有碳酸钠,故C错误;
D、反应生成碳酸钠的质量为10.6g,故D错误。故选B。

 阅读快车系列答案
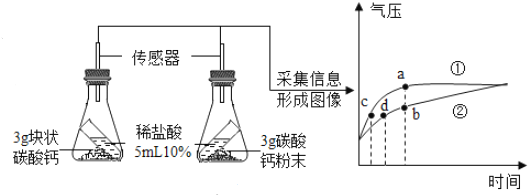
阅读快车系列答案【题目】实验室常用如图装置测定空气中氧气的含量。
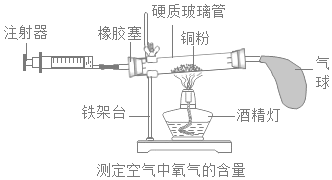
(实验原理)该实验反应的原理是______(用方程式表示)。
(实验步骤)具体实验步骤有:
①在硬质玻璃管中装入铜粉,两端塞上带导管的橡皮塞,其中一端用气球密封;
②测量出实验所用硬质玻璃管的容积;
③停止加热后,待试管冷却至室温,注射器活塞稳定后,记录注射器中气体的体积;
④酒精灯在铜粉部位加热,加热时不断推拉注射器:
⑤移动注射器活塞,在注射器中留下一定体积的气体,记录体积后与硬质玻璃管另一端密封连接,并将硬质玻璃管固定在铁架台上。
(1)正确的操作步骤为______(填数字序号);
(2)在实验加热过程中,硬质玻璃管中观察到的现象是______;缓慢推拉注射器活塞的目的是______;
(实验记录)如表是甲、乙、丙三组同学记录的实验数据:
实验 小组 | 硬质玻璃管的容积/mL | 反应前注射器中气体体积/mL | 反应后注射器中气体体积/mL | 反应消耗的氧气体积/mL | 空气中氧气的体积分数(%) |
甲 | 45 | 15 | 4 | 11 | 18.3 |
乙 | 40 | 18 | 5 | 13 | 22.4 |
丙 | 50 | 20 | 6 | ______ | ______ |
填写上表中空白,帮助丙组同学完成实验数据的统计;
(实验分析)从上述数据中可知,该实验存在一定误差,导致该实验数据比21%小的原因不可能是______(填数字序号)。
①没有缓缓推拉注射器活塞;
②读数时没有冷却至室温;
③加入铜丝量太多;
④反应后读数时小气球中气体未全部挤出
【题目】如图是水的电解实验装置图.
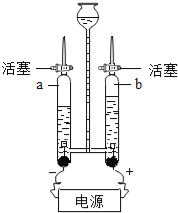
(1)该实验中,与两个电极相连的a、b两支玻璃管中产生的气体分别是 和 ,体积比约为 .
(2)该实验证明了水是由 组成的.
(3)下列行为,不利于保护水资源的是 (填序号).
A.工业用水重复使用 |
B.大量使用化肥和农药 |
C.加强城市污水处理系统的建设 |
D.用喷灌方法给农作物浇水 |