题目内容
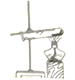
【题目】小明要配制100 g溶质质量分数为18.5%的氯化钠溶液,如图是他配制该溶液的示意图.

(1)图中共有______处错误(说明:天平的两个托盘上都垫有纸).
(2)量取所需要的水应选择______(选填“10mL”、“50mL”或“100mL”)量筒.
(3)用图示的序号表示配制溶液的操作顺序:______.
(4)下列因素会使所配溶液溶质质量分数偏小的是______(填序号)
①药品和砝码放错了盘 ②量取水时仰视量筒刻度 ③所用烧杯内事先残留少量蒸馏水 ④将所配溶液转入试剂瓶时,不慎洒到外面少量.⑤使用粗盐代替氯化钠进行配制.
【答案】2 100mL ④①③⑤② ①②③⑤
【解析】
(1)用天平称量固体物质的质量时,应该将药品放在左盘,砝码在右盘,所以①错误;用量筒量取液体体积时,应该平视凹液面的最低处,故③错误;
(2)配制100g质量分数为18.5%的氯化钠溶液,所需氯化钠的质量为100g×18.5%=18.5g,需要水的质量为100g﹣18.5g=81.5g,而水一般采用量体积的方法,所以水的体积为81.5mL,选择量筒时,应该超过所取液体的体积数且接近性原则;
(3)配制该溶液的操作顺序为计算、称量、量取、溶解,所以序号为④①③⑤②;
(4)药品和砝码放错了盘、使用粗盐代替氯化钠进行配制,都会导致溶质质量减少,所以溶质质量分数偏小;量取水时仰视量筒刻度、所用烧杯内事先残留少量蒸馏水会导致溶剂质量增多,所以会使溶质质量分数偏小,而将所配溶液转入试剂瓶时,不慎洒到外面少量,溶液质量有损失,而溶质质量分数不变。

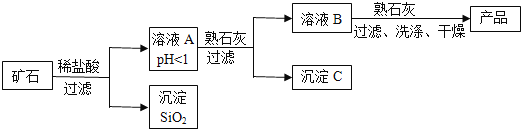
【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
请回答下列问题:
(1)溶液A中共含有______种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式______(只写一个)
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀,该实验条件下,使金属阳离子沉淀的相关pH数据见表。为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围为是______;
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(3)写出溶液B中加入熟石灰发生的化学反应方程式______。
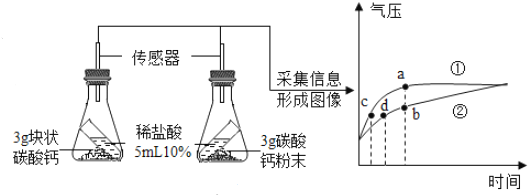
【题目】实验室常用如图装置测定空气中氧气的含量。
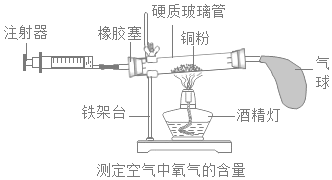
(实验原理)该实验反应的原理是______(用方程式表示)。
(实验步骤)具体实验步骤有:
①在硬质玻璃管中装入铜粉,两端塞上带导管的橡皮塞,其中一端用气球密封;
②测量出实验所用硬质玻璃管的容积;
③停止加热后,待试管冷却至室温,注射器活塞稳定后,记录注射器中气体的体积;
④酒精灯在铜粉部位加热,加热时不断推拉注射器:
⑤移动注射器活塞,在注射器中留下一定体积的气体,记录体积后与硬质玻璃管另一端密封连接,并将硬质玻璃管固定在铁架台上。
(1)正确的操作步骤为______(填数字序号);
(2)在实验加热过程中,硬质玻璃管中观察到的现象是______;缓慢推拉注射器活塞的目的是______;
(实验记录)如表是甲、乙、丙三组同学记录的实验数据:
实验 小组 | 硬质玻璃管的容积/mL | 反应前注射器中气体体积/mL | 反应后注射器中气体体积/mL | 反应消耗的氧气体积/mL | 空气中氧气的体积分数(%) |
甲 | 45 | 15 | 4 | 11 | 18.3 |
乙 | 40 | 18 | 5 | 13 | 22.4 |
丙 | 50 | 20 | 6 | ______ | ______ |
填写上表中空白,帮助丙组同学完成实验数据的统计;
(实验分析)从上述数据中可知,该实验存在一定误差,导致该实验数据比21%小的原因不可能是______(填数字序号)。
①没有缓缓推拉注射器活塞;
②读数时没有冷却至室温;
③加入铜丝量太多;
④反应后读数时小气球中气体未全部挤出
【题目】如图是水的电解实验装置图.
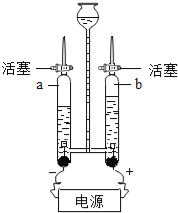
(1)该实验中,与两个电极相连的a、b两支玻璃管中产生的气体分别是 和 ,体积比约为 .
(2)该实验证明了水是由 组成的.
(3)下列行为,不利于保护水资源的是 (填序号).
A.工业用水重复使用 |
B.大量使用化肥和农药 |
C.加强城市污水处理系统的建设 |
D.用喷灌方法给农作物浇水 |