题目内容
)已知木炭还原氧化铜实验中发生的主要反应:C+2CuO 2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
探究一:检验产物的成份
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体.暗红色固体是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4═CuSO4+Cu+H2O.
【猜想与假设】暗红色固体除铜外还可能含有Cu2O.
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到现象: ,说明暗红色固体含有Cu2O.
探究二:测定产物中Cu2O的含量
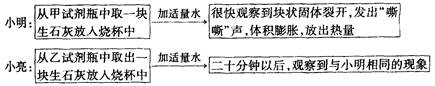
原理:Cu2O+H2 2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是 ;
(2)若不加装置e,实验结果会偏高,原因是 ;
(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2,关闭K1 ②检查装置的气密性
③连接仪器 ④关闭K2,打开K1,通氢气一段时间
(4)还可通过测定反应前后装置 (填“a”、“b”或“c”)的质量达到实验目的.
探究一:固体部分溶解,溶液变成蓝色.探究二:(1)盐酸易挥发,挥发出的氯化氢能被碱石灰吸收,影响测定结果.(2) d中的碱石灰能够吸收空气中的水和二氧化碳;(3) ③②④①.(4)C
解析

 教材全解字词句篇系列答案
教材全解字词句篇系列答案某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。
(1)写出该中和反应的化学方程式_______________________。
(2)探究烧杯内溶液中溶质的成分:
【作出猜想】
(A)溶质可能是CaCl2与Ca(OH)2
(B)溶质可能是CaCl2
(C)溶质可能是CaCl2与HCl
【查阅资料】CaCl2溶液呈中性
【实验设计】
①取少量烧杯中的溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是排除了猜想(A),你认为排除猜想(A)的理由是_____________。
②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格:
| 实验步骤 | 预计现象 | 预计结论 |
| 取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液 | | 猜想(B)正确 |
| | 猜想(C)正确 |
A.取反应后的溶液于试管中,滴加紫色石蕊试液变红色
B.取反应后的溶液于试管中,加入锌粉冒气泡
C.用洁净的玻璃棒蘸取反应后的溶液,涂抹在pH试纸上,测溶液的pH <7
D.取反应后的溶液于试管中,加入硝酸银溶液,生成白色沉淀
(6分)甲为初中化学常见物质,请根据下列叙述回答问题。
(1)若甲可以用于灭火,将甲通入紫色石蕊试液中,观察到试液变红色,发生反应的化学
方程式为__________。
(2)若甲是一种红色固体氧化物,将甲放入过量的稀盐酸中,观察到固体消失, 。
反应后所得溶液的溶质为__________。
(3)若甲含有4种元素且能与稀盐酸反应产生气泡。向甲的溶液中加入过量氢氧化钠溶液,发生反应生成乙和水,但无明显现象;向反应后的溶液中逐滴滴加稀盐酸,一段时间后产生气泡。甲与氢氧化钠溶液的反应方程式为___________。
(4)若一定量的甲与乙在一定条件下发生反应,下列情况与图像的对应关系正确的是 __________ (填序号)。
| | 甲 | 乙 | y轴含义 |
| A | 生石灰 | 水 | 固体质量 |
| B | 铜锌合金粉末 | 硫酸铜溶液 | 溶液质量 |
| C | 工业炼铁的尾气 | 氢氧化钠溶液 | 气体质量 |
| D | 密闭容器中的空气 | 红磷 | 反应过程中容器内压强 |