题目内容
【题目】(15分)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为 。
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
(1)取少量样品溶于水,加入 ; | 白色沉淀产生 | 该反应的化学方程式: ; |
(2)将上述反应后的混合物过滤,取滤液加入 。 | 。 | 证明猜想Ⅱ正确 |
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
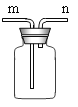
【实验探究2】小红同学设计如下图所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:

①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液220mL。
请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是 ;
(2)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是 ;
(3)试管中原有的空气对实验结果是否有明显影响? (填“有”或“没有”)
(4)变质氢氧化钠样品中碳酸钠的质量分数为 。(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如下图所示的实验流程。
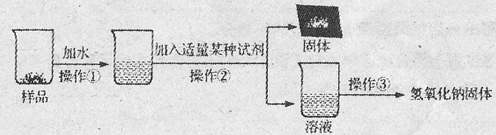
请回答下列问题:
(1)操作①、②、③的名称分别为 ,为了使样品充分溶解,操作①中还要用到的玻璃仪器是 ;
(2)该实验中发生反应的化学方程式为 ;
(3)最终所得氢氧化钠固体质量 变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”)。
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质样品中某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有 (填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(2)实验探究Ⅰ中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,分别是 。
【答案】(1)2NaOH+CO2==Na2CO3+H2O
【实验探究1】过量的氯化钙溶液 Na2CO3+CaCl2==CaCl2+ CaCO3↓
酚酞试液溶 液液变为红色
【实验探究2】(1)检查装置的气密性。
(2)避免二氧化碳溶解于水,造成结果偏低。
(3)没有
(4)48%
【实验探究3】(1) 溶解、过滤、蒸发 玻璃棒
(2) Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
(3) 大于
【实验反思】(1)①②④⑤⑥
(2)实验探究1中将碳酸钠转化为氯化钠的目的是排除对氢氧化钠检验的干扰;而实验探究3除杂时是为了除去产品中的杂质而将碳酸钠转化为产品氢氧化钠。
【解析】
试题分析:(1)氢氧化钠变质是与二氧化碳发生了化学反应,化学方程式为2NaOH+CO2==Na2CO3+H2O
【实验探究1】因为猜想Ⅱ为固体成分为碳酸钠和氢氧化钠。根据题意可知:碳酸钠可与氯化钙反应生成碳酸钙沉淀。所以可向溶液中加入过量的氯化钙溶液,会观察到有白色的沉淀生成。反应的化学方程式为:Na2CO3+CaCl2==CaCl2+ CaCO3↓
然后可向滤液中再加入酚酞试液(或紫色石蕊试液),当观察到酚酞试液变为红色(或紫色石蕊试液变蓝色)可说明溶液中有碱性物质存在,即固体中含氢氧化钠。结合上步操作中的现象即可判断猜想Ⅱ正确。
【实验探究2】(1)该装置的目的是通过测量生成二氧化碳气体的体积来计算出碳酸钠的质量。要求装置气密性要良好。所以加药品反应前应先检查装置的气密性。
(2)二氧化碳可溶于水,但几乎不溶解于饱和的碳酸氢钠溶液。所以可起到避免二氧化碳溶解于水,造成结果偏低。
(3)装置内原有的空气中的物质不参与实验中的反应,也没有排出实验装置,所以不会影响实验结果。
(4)量筒内收集到220ml饱和碳酸氢钠溶液,即生成二氧化碳气体的体积为220ml。所以生成二氧化碳的质量为220ml×1.8g/L=0.396g
设样品中含碳酸钠的质量为x,则;
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 44
x 0.396g
10644=x:0.396g
x=0.954g
样品中含碳酸钠的质量分数为:![]() ×100%≈48%
×100%≈48%
【实验探究3】(1)操作①的作用是将样品与水混合后形成溶液,所以操作①为溶解;操作②将原混合物分离为固体和液体两部分,所以操作②为过滤;操作③将溶液中的氢氧化钠析出为氢氧化钠固体,去除了水,所以操作③为蒸发。 为使固体充分溶解,操作①中还要用到的玻璃仪器为玻璃棒,其作用是搅拌加快固体溶解。
(2)该实验中加入的试剂的作用是与碳酸钠反应生成一种沉淀和氢氧化钠,所以所用的试剂为氢氧化钙;反应的化学方程式为:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
(3)因为上面的反应会生成氢氧化钠,所以最终所得的氢氧化钠的质量大于样品中氢氧化钠的质量。
【实验反思】(1)根据上述实验可知,在实验探究过程中我们要考虑的因素有:选择试剂的种类;确定试剂用量;实验装置与步骤的设计;实验安全环保;测量中减少误差。上述因素均能影响实验结果。试剂产地不需要考虑。
(2)实验探究1中将碳酸钠转化为氯化钠的目的是排除对氢氧化钠检验的干扰;而实验探究3除杂时是为了除去产品中的杂质而将碳酸钠转化为产品氢氧化钠。

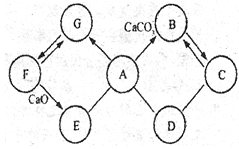
【题目】下表所列各组物质中,物质之间较下图箭头方向,通过一步反应就能实验的是
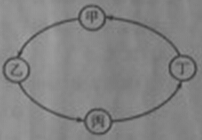
选项 | 甲 | 乙 | 丙 | 丁 |
A | Cu | CuO | CuSO4 | Cu(OH)2 |
B | Na2CO3 | CaCO3 | CaO | Ca(OH)2 |
C | H2SO4 | Na2SO4 | BaSO4 | Ba(OH)2 |
D | CO2 | CaCO3 | H2O | O2 |