题目内容
【题目】化学是一门以实验为基础的科学,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
查阅资料:
①浓硫酸可以吸收气体中的水蒸气,可以作为气体干燥剂。
②氨气是有刺激性气味的无色气体,密度比空气小,极易溶于水。
③加热熟石灰和氯化铵的固体混合物生成氨气。
④湿润的红色石蕊试纸遇到氨气变蓝色。
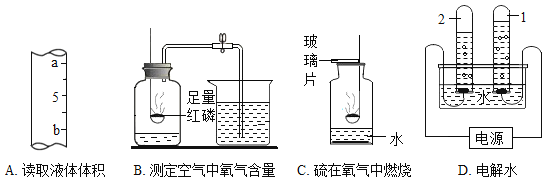
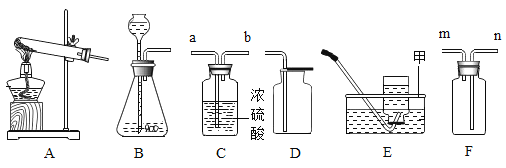
(1)上图E装置中,甲仪器的名称是__________。
(2)写出用图A装置制O2的化学方程式:______________ ,若在试管口塞一小团棉花,则制O2的化学方程式为:_____________,实验室用双氧水和二氧化锰混合制O2的发生装置可选用_______(填装置序号),用装置C干燥O2,气体由导管_____端(填“a”或“b”)进人;若用E装置收集氧气,需等气泡_________________________的冒出时再收集。
(3)英国化学家布莱克是第一个“捕捉”到二氧化碳的人,实验室制备CO2的化学方程式为:_______________________________________,若用D装置收集,验证已经收集满的方法是:_____________________________________。
(4)制取氨气的发生装置可选用____(填装置序号),若用F装置收集氨气,进气口应为___端(填“m”或“n”),验证氨气集满的方法是___________________________________________。
【答案】水槽 2KClO3 ![]() 2KCl+3O2↑ 2KMnO4
2KCl+3O2↑ 2KMnO4 ![]() K2 MnO4 + MnO2 +O2↑ B a 连续均匀 CaCO3+2HCl=CaCl2+H2O+CO2↑ 将燃着的木条放在集气瓶口,若熄灭,则满 A n 将湿润的红色石蕊试纸放在m处,若变蓝,则满
K2 MnO4 + MnO2 +O2↑ B a 连续均匀 CaCO3+2HCl=CaCl2+H2O+CO2↑ 将燃着的木条放在集气瓶口,若熄灭,则满 A n 将湿润的红色石蕊试纸放在m处,若变蓝,则满
【解析】
(1)仪器甲是水槽;故填:水槽;
(2)图A装置是固固加热型,且试管口没有放棉花,是氯酸钾和二氧化锰制取氧气,反应的化学方程式为:2KClO3 ![]() 2KCl+3O2↑;若在试管口塞一小团棉花,则是高锰酸钾制取氧气,化学方程式为:2KMnO4
2KCl+3O2↑;若在试管口塞一小团棉花,则是高锰酸钾制取氧气,化学方程式为:2KMnO4 ![]() K2 MnO4 + MnO2 +O2↑;实验室用双氧水和二氧化锰混合制O2不需要加热,发生装置可选用B;用装置C干燥O2,气体由导管a端进人;若用E装置收集氧气,需等气泡连续均匀的冒出时再收集。
K2 MnO4 + MnO2 +O2↑;实验室用双氧水和二氧化锰混合制O2不需要加热,发生装置可选用B;用装置C干燥O2,气体由导管a端进人;若用E装置收集氧气,需等气泡连续均匀的冒出时再收集。
故填:2KClO3 ![]() 2KCl+3O2↑; 2KMnO4
2KCl+3O2↑; 2KMnO4 ![]() K2 MnO4 + MnO2 +O2↑;B;a;连续均匀。
K2 MnO4 + MnO2 +O2↑;B;a;连续均匀。
(3)实验室常用大理石(或石灰石)和稀盐酸反应制取二氧化碳,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;若用D装置收集,验证已经收集满的方法是:将燃着的木条放在集气瓶口,若熄灭,则满。
故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;将燃着的木条放在集气瓶口,若熄灭,则满。
(4)加热熟石灰和氯化铵的固体混合物生成氨气,属于固、固加热型,适合用装置A作发生装置;氨气是有刺激性气味的无色气体,密度比空气小,极易溶于水,若用F装置收集氨气,进气口应为n,验证氨气集满的方法是:把湿润的红色石蕊试纸放到m导管口处,如果试纸变蓝色,则集满。
故填:A;n;将湿润的红色石蕊试纸放在m处,若变蓝,则满。

【题目】(探究活动一)为探究催化剂的种类对氯酸钾分解速率的影响,甲同学设计如表对比实验:
氯酸钾的质量 | 催化剂的种类 | 催化剂 的质量 | 反应条件 | 收集45.0mLO2所需的时间(s) | |
Ⅰ | 3.0g | MnO2 | 1.0g | 混合加热 | 21 |
Ⅱ | xg | CuO | 1.0g | 混合加热 | 48 |
(1)表Ⅱ中x的值应为___________;通过分析上表数据,可以得出的实验结论是:在相同的条件下,KClO3在MnO2作催化剂比CuO作催化剂的分解速率_______ (选填“快”或“慢”);写出氯酸钾、二氧化锰加热反应的文字表达式________。
(探究活动二)为探究过氧化氢浓度对过氧化氢分解速率的影响,乙同学设计以下实验:
[进行实验]
室温下,选用50.0g不同溶质质量分数的过氧化氢溶液(1%、2%和4%)分别与0.1g二氧化锰进行实验(如图1,固定夹持仪器略去)。
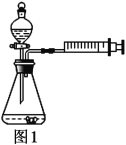
(2)MnO2在H2O2分解前后其质量和__________没有发生改变,试写出H2O2分解反应的文字表达式________。
[数据处理]
(3)乙同学进行实验后,获得的相关实验数据记录如表所示:
过氧化氢溶液的质量 | 过氧化氢的浓度 | MnO2的质量 | 温度 | 相同时间(10s)内产生O2体积(mL) | |
Ⅰ | 1% | 0.1g | 20℃ | 9 | |
Ⅱ | 50.0g | 2% | 0.1g | 20℃ | 16 |
Ⅲ | 50.0g | 4% | 0.1g | 20℃ | 31 |
①本实验中,测量O2体积的装置也可以选用如图2的哪套装置来代替_________(填编号)。
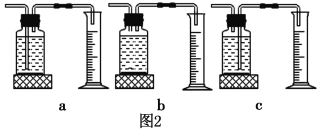
②分析上表数据,可以得出不同浓度的过氧化氢对过氧化氢分解速率影响的结论是:_________
【题目】研究性学习小组选择“过氧化氢(![]() )生成氧气(
)生成氧气(![]() )的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
)的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
(假设)![]() 生成
生成![]() 的快慢与催化剂种类有关。
的快慢与催化剂种类有关。
(实验方案)常温下,在两瓶同质量、同浓度的![]() 溶液中,分别加入相同质量的
溶液中,分别加入相同质量的![]() 和水泥块,测量各生成一瓶(相同体积)
和水泥块,测量各生成一瓶(相同体积)![]() 所需的时间。
所需的时间。
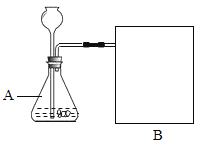
(进行实验)下图是他们进行实验的装置图,气体发生装置中A仪器的名称是________,此实验中B处宜采用的气体收集方法是________。
(实验记录)
实验编号 | 1 | 2 |
反应物 |
|
|
催化剂 | 1g水泥块 |
|
时间 | 165 s | 46 s |
(结论)该探究过程得出的结论是________________________________________。
(反思)![]() 在常温下分解缓慢,加入
在常温下分解缓慢,加入![]() 或水泥块后反应明显加快。若要证明二氧化锰(
或水泥块后反应明显加快。若要证明二氧化锰(![]() )和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的________________________是否改变。
)和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的________________________是否改变。
(实验拓展)![]() 生成
生成![]() 的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现象 | 结论 |
取一支试管加入5 mL 5%的过氧化氢溶液,然后加入等量的二氧化锰。 | 缓慢有少量气泡冒出 | ________________ |
另取一支试管加入5 mL 15%的过氧化氢溶液,然后加入等量的二氧化锰。 | 迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二: ________________
实验步骤 | 现象 | 结论 |
取一支试管加入5 mL 15%的过氧化氢溶液,把试管放入盛有热水的烧杯中 | ________________ | 温度越高,过氧化氢分解的速率越大 |
取一支试管加入5 mL 15%的过氧化氢溶液,把试管放入盛有________的烧杯中 | ________________ |
【题目】在研究“酸碱中和反应”时,某兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后是否发生了化学反应,进行了如下探究:
(1)在盛有氢氧化钠溶液的烧杯中滴人几滴酚酞试液,再逐滴加入稀盐酸,并不断搅拌(如图一)。用数字化传感器测得盐酸与氢氧化钠溶液混合前后的温度变化情况(如图二)。
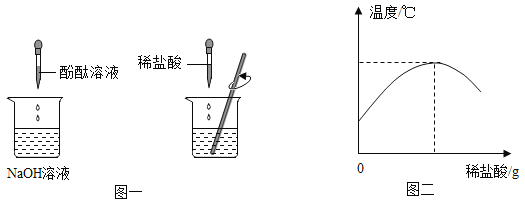
图一实验中滴加稀盐酸后发生的现象为__________________;由实验现象和曲线变化情况分析可知,盐酸和氢氧化钠溶液发生了反应并________(填“吸收”或“放出”)热量。
(2)从微观角度分析盐酸与氢氧化钠溶液的反应如图描述了该反应的微观实质,图中A、B、C处应填入的化学符号依次是____________。

(3)同学们讨论后认为,如果用检验盐酸和氢氧化钠减少(或消失)、或者有新物质生成,都能证明反应已经发生。继续探究实验后烧杯中溶质的成分,来证明反应的发生。
步骤 | 现象 | 结论 |
实验1:取烧杯中的溶液少许于试管中,加入硫酸铜溶液 | ____________________________ | 证明没有 |
实验2:另取烧杯中的溶液少许于试管中,加入硝酸银溶液 | 出现白色沉淀 | 证明含有 |
实验3:再取烧杯中的溶液少许于蒸发皿中,加热蒸干 | 有___________产生 | 证明有 |
(得出结论)氢氧化钠溶液和盐酸发生了中和反应。
(评价反思)有同学认为,仅通过实验2得出“溶液中含有![]() ”证据不足,理由是___________________。
”证据不足,理由是___________________。