题目内容
【题目】为了解某NaCl、Na2CO3固体混合物中Na2CO3与盐酸的反应情况,张南同学取16g该混合物放入烧杯中,分五次加入稀盐酸(每次加入稀盐酸的质量为25g),待反应完全后,得到下表中相关数据,请分析表格中数据,回答下列问题。
加入稀盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
烧杯及反应后混合物的总质量/g | 122.2 | 146.1 | 170.0 | 193.9 | 218.9 |
(1)写出发生反应的化学方程式___;
(2)列出求解该混合物中碳酸钠质量(x )的比例式___;
(3)前三次加酸后参加反应碳酸钠质量占原混合物中碳酸钠质量的百分比为___;
(4)当加入稀盐酸至固体混合物恰好完全反应时,若向所得不饱和溶液中加入59.4g蒸馏水,最终所得溶液中溶质的质量分数是___;
(5)若用36.5%的浓盐酸配制上述所需要的盐酸,则需要加水的质量为___。
【答案】Na2CO3+2HCl═2NaCl+H2O+CO2↑ ![]() 75% 10% 100g
75% 10% 100g
【解析】
碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
根据第二次和第三次以及第四次加入盐酸都是减少1.1g,所以第一次也是减少1.1g,而第五次没有减少,说明前四次已经恰好完全反应。所以生成二氧化碳的总质量为4.4g。
前四次每次反应掉的碳酸钠质量相等,因而前三次反应掉的碳酸钠的质量占总碳酸钠的75%;
设恰好完全反应时参加反应的碳酸钠的质量为x,HCl的质量为y,生成的氯化钠的质量为z
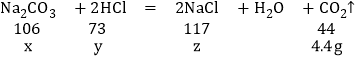
![]() =
=![]() =
=![]() =
=![]()
x=10.6g
y=7.3g
z=11.7g
所用盐酸中HCl的质量分数为![]() ×100%=7.3%
×100%=7.3%
恰好完全反应时加入59.4g水得到的溶液的溶质的质量分数为:![]() ×100%=10%
×100%=10%
设用36.5%的浓盐酸配制7.3%稀盐酸25g×5时需要的浓盐酸的质量为a
36.5%a=7.3%×25g×5
a=25g
则需要加的水的质量为25g×5﹣25g=100g
故答案为:(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)![]() =
=![]() ;
;
(3 ) 75%;
(4)10%;
(5)100g。