题目内容
【题目】在做酸碱中和反应的实验时,某同学向盛有NaOH溶液的烧杯中加入一定量的稀盐酸后没有观察到明显现象。同学们产生疑问:反应后溶液中的溶质是什么呢?对此同学们展开了以下实验探究。
(假设猜想)同学们给出了以下猜想:
①只有NaCl;②有NaCl和HCl;③有NaCl和NaOH;④有NaCl、HCl和NaOH;
你认为上述猜想中肯定不成立的是______(填序号)。
(实验探究)为了探究反应后溶液的溶质成分,同学们做了如下实验:
(1)李明同学取少量烧杯中的溶液于试管中,向其中滴加几滴无色酚酞试液,溶液没有明显变化,则溶液中一定没有______。
(2)张华也取少量烧杯中的溶液于试管中,向其中加入Zn,发现立即产生大量的气泡,则产生气泡的化学方程式为______,证明猜想②正确。
(3)李明又说,用Fe2O3固体同样也可以探究出猜想②正确,请你帮他写出具体的实验操作和现象:______。
(4)受同学们的启发,小丽说用pH试纸也可以来探究,于是她用如图所示方法测定该溶液的pH,也得出了正确的结论。但她这样操作会产生的不良后果是______。
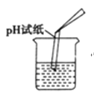
【答案】④ 氢氧化钠 Zn+2HCl=ZnCl2+H2↑ 取少量烧杯中的溶液于试管中,加适量Fe2O3固体,一段时间后固体逐渐溶解,溶液变成黄色 污染原溶液
【解析】
假设猜想:
氢氧化钠和盐酸反应会生成氯化钠和水,所以上述猜想中肯定不成立的是④;
实验探究:
(1)酚酞遇碱变红色,所以取少量烧杯中的溶液于试管中,向其中滴加几滴无色酚酞试液,溶液没有明显变化,则溶液中一定没有氢氧化钠;
(2)锌和稀盐酸反应生成氯化锌和氢气,化学方程式为:Zn+2HCl=ZnCl2+H2↑;
(3)氧化铁和盐酸反应生成氯化铁和水,所以具体的实验操作和现象是:取少量烧杯中的溶液于试管中,加适量Fe2O3固体,一段时间后固体逐渐溶解,溶液变成黄色;
(4)pH测定溶液pH值的正确操作是:不能将pH试纸伸入待测溶液中,这样操作会产生的不良后果是:污染原溶液。

【题目】为了解某NaCl、Na2CO3固体混合物中Na2CO3与盐酸的反应情况,张南同学取16g该混合物放入烧杯中,分五次加入稀盐酸(每次加入稀盐酸的质量为25g),待反应完全后,得到下表中相关数据,请分析表格中数据,回答下列问题。
加入稀盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
烧杯及反应后混合物的总质量/g | 122.2 | 146.1 | 170.0 | 193.9 | 218.9 |
(1)写出发生反应的化学方程式___;
(2)列出求解该混合物中碳酸钠质量(x )的比例式___;
(3)前三次加酸后参加反应碳酸钠质量占原混合物中碳酸钠质量的百分比为___;
(4)当加入稀盐酸至固体混合物恰好完全反应时,若向所得不饱和溶液中加入59.4g蒸馏水,最终所得溶液中溶质的质量分数是___;
(5)若用36.5%的浓盐酸配制上述所需要的盐酸,则需要加水的质量为___。
【题目】在一个密闭容器中有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下:
物质 | X | Y | Z | Q |
反应前质量/g | 4 | 10 | 1 | 21 |
反应前质量/g | 0 | 12 | 15 | 待测 |
已知X的相对分子质量为n,Q的相对分子质量为2n,则下列推断正确的是( )
A. 反应后Q的质量为10g
B. 反应式中X与Q的化学计量数比为2:3
C. 反应后生成15gZ
D. 反应中Y与Q发生改变的质量比为1:6