题目内容
【题目】某化学兴趣小组的同学在老师的指导下,进行如下实验活动。
I.用98%的浓硫酸(p=1.84g/cm3)配制100g10%的硫酸,所需浓硫酸的体积为___mL(计算结果精确到0.1);量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数__10%(填“>”“<”或“=”)。
Ⅱ.有一包固体粉末,可能含有硝酸钾、氯化钠、碳酸钠、硫酸钠、硫酸铜中的一种或几种为探究该固体粉末的组成,小组同学取50g样品按如下流程进行实验:
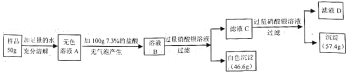
根据上述实验现象及数据,回答下列问题:
(1)由上述实验现象及数据分析,原固体粉末中一定不含有__(填化学式),一定含有___(填化学式)。
(2)滤液D中共含有___(填数字)种溶质。
(3)原固体粉末中含量最少的物质的质量为___g。
【答案】5.5 > CuSO4、Na2CO3 Na2SO4、NaCl、KNO3 4 9.9
【解析】
I.溶液稀释前后溶质的质量相等,设用98%的浓硫酸(p=1.84g/cm3)配制100g10%的硫酸,所需浓硫酸的体积为x,x×1.84g/cm3×98%=100g×10%,解得x≈5.5mL;量取浓硫酸时,若仰视读数(其他操作均正确),则所量取的浓硫酸偏多,所配硫酸的质量分数>10%。
Ⅱ.(1)样品加足量的水,充分溶解,得到无色溶液,则样品中无硫酸铜。加入盐酸,无气泡产生,样品中无碳酸钠。加过量硝酸钡溶液,产生白色沉淀,则样品中含有硫酸钠。设加入100g7.3%盐酸时,生成氯化银沉淀的质量为x。
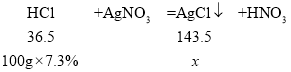
![]() ,解得x=28.7g
,解得x=28.7g
由流程图可知,加入过量硝酸银溶液生成57.4g沉淀,所以样品中含有氯化钠。设样品中氯化钠的质量为y。
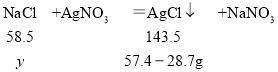
![]() ,解得y=11.7g
,解得y=11.7g
设样品中硫酸钠的质量为z。
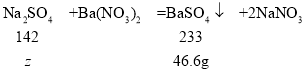
![]() ,解得z=28.4g
,解得z=28.4g
样品中氯化钠与硫酸钠的质量之和为:11.7g+28.4g=40.1g<50g,故样品中还含有硝酸钾,其质量为:50g-40.1g=9.9g。由上述实验现象及计算知道,原固体粉末中一定不含有CuSO4、Na2CO3,一定含有Na2SO4、NaCl、KNO3。
(2)过程中发生的反应有:Na2SO4+Ba(NO3)2 =BaSO4↓+2NaNO3、HCl+AgNO3=AgCl↓+HNO3、则滤液D中含有NaNO3、HNO3、Ba(NO3)2、AgNO3共4种溶质。
(3)由以上的计算可知,原固体粉末中含有11.7gNaCl、28.4gNa2SO4、9.9gKNO3,含量最少的物质是KNO3,其质量为9.9g。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案【题目】硼是作物生长必需的微量营养元素,硼元素的相关信息如图所示。下列有关硼的说法正确的是( )
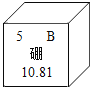
A.相对原子质量为10.81gB.硼元素在化合物中常显+5价
C.原子的核电荷数为5D.原子核外有6个电子
【题目】下表是几种物质在20℃的溶解度和相对分子质量。回答下列问题:
物质 | NaCl | NaHCO3 | NH4Cl | NH4HCO3 |
溶解度/g | 36.0 | 9.6 | 37.2 | 21.0 |
相对分子质量 | 58.5 | 84 | 53.5 | 79 |
(1)20℃时,用50g蒸馏水配制饱和NaHCO3溶液。
①计算需称量NaHCO3的质量是_____g。
②将称量的NaHCO3固体倒入盛有50g蒸馏水的烧杯中,然后用_____(填仪器名称)不断搅拌,直至_____。
③用配制所得的溶液可处理溶质的质量分数为1%的稀H2SO4_____g。
(2)相同温度下,不同溶质同时溶解在同一溶剂中,溶解度不变。在20℃时,将11.7gNaCl固体和15.8gNH4HCO3固体同时放入盛有100g水的烧杯中,充分搅拌,静置,观察到烧杯底部有晶体出现,该过程只发生复分解反应。杯底的晶体是_____,杯底晶体的质量是_____g。