题目内容
【题目】实验室以MnO2为原料制备少量高纯MnCO3的流程如下
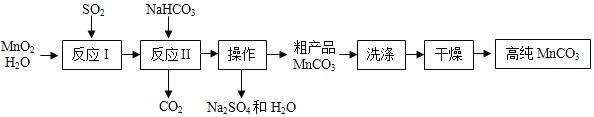
已知:①反应I的化学方程式:![]() ;②MnCO3、Mn(OH)2均难溶于水,MnCO3在100 °C时开始分解。
;②MnCO3、Mn(OH)2均难溶于水,MnCO3在100 °C时开始分解。
(1)反应I属于基本反应类型中的__反应。
(2)反应Ⅱ的化学方程式为_____。该反应需控制溶液的酸碱性,若碱性过强,MnCO3 粗产品中将混有_____(填化学式)。
(3)MnCO3粗产品表面附着有杂质__(填化学式);验证完全除去该杂质的操作,取样品少许,向其中加入___,搅拌、过滤,向滤液中加入适量的___(填化学式)溶液,观察到__。
(4)为获得高纯MnCO3,需选择干燥的条件是__(填字母)。
A 低温 B 高温 C 高于100 °C
【答案】化合 ![]() Mn(OH)2 Na2SO4 适量水 BaCl2(合理即可) 没有白色沉淀生成 A
Mn(OH)2 Na2SO4 适量水 BaCl2(合理即可) 没有白色沉淀生成 A
【解析】
(1)反应I的化学方程式为![]() ,该反应是由两种物质生成一种物质的反应,属于化合反应;
,该反应是由两种物质生成一种物质的反应,属于化合反应;
(2)根据流程图和质量守恒定律可知,反应Ⅱ是MnSO4与NaHCO3反应生成MnCO3、CO2、Na2SO4和H2O,反应的化学方程式为:![]() ;该反应需控制溶液的酸碱性,若碱性过强,MnCO3 粗产品中将混有Mn(OH)2;
;该反应需控制溶液的酸碱性,若碱性过强,MnCO3 粗产品中将混有Mn(OH)2;
(3)根据反应Ⅱ可知,MnCO3粗产品表面附着有杂质Na2SO4;MnCO3不溶于水,Na2SO4溶于水,硫酸钠与氯化钡反应能生成硫酸钡的白色沉淀。验证完全除去该杂质的操作,取样品少许,向其中加入适量水,搅拌、过滤,向滤液中加入适量的BaCl2溶液,观察到没有白色沉淀生成;
(4)根据“MnCO3在100 °C时开始分解”可知,为获得高纯MnCO3,需选择干燥的条件是低温。故选A。

练习册系列答案
相关题目