题目内容
【题目】某合金粉末中含有铜、银、铬(Cr),为了从中回收贵金属银和一种盐晶体,某化学兴趣小组的同学们将这三种金属随意编号为:A、B、C,设计了如下实验流程: 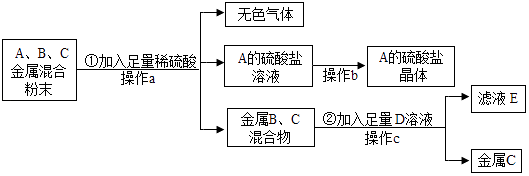
(1)A、B、C三种金属的活动性顺序由大到小为(用化学式作答) .
(2)操作a中除烧杯、玻璃棒外还需用到的玻璃仪器是 , 操作b的名称是 .
(3)已知A的硫酸盐中A元素是+2价,请写出步骤①的化学反应方程式 .
(4)已知D易溶于水,溶液D中的溶质是(写化学式) , 写出步骤②的化学反应方程式 .
(5)溶液D的质量(填“大于”、“小于”或“等于”)溶液E的质量.
【答案】
(1)Cr>Cu>Ag
(2)漏斗;蒸发
(3)Cr+H2SO4═CrSO4+H2↑
(4)AgNO3;Cu+2AgNO3═Cu(NO3)2+2Ag
(5)大于
【解析】解:(1)在金属活动性顺序中,铜、银排在氢的后面,所以不能与酸反应放出氢气,由题意可知三种金属中只有A能与稀硫酸反应生成无色气体和A的盐溶液,所以我们判断A是Cr,金属B、C的混合物加入足量的含硝酸银的回收液中,过滤后得到金属C,说明金属C不能与硝酸银溶液反应,金属B能与硝酸银溶液反应,我们在教材中学过“在金属活动性顺序中,只有排在前面的金属才能把排在后面的金属从它的盐溶液中置换出来”,所以我们得知金属B的活动性大于金属C的活动性,又因为在金属活动性顺序中,铜排在银的前面,所以B是Cu,C是银,所以A、B、C三种金属的活动性顺序为:Cr>Cu>Ag.(2)操作a能将固液分开,操作是过滤,除烧杯、玻璃棒外还需用到的玻璃仪器是漏斗,操作b是从溶液中得到晶体,名称是蒸发.(3)通过上述分析可知,A是Cr,硫酸盐中Cr元素是+2价,步骤①的化学反应方程式是:Cr+H2SO4═CrSO4+H2↑.(4)由上述分析可知,溶液D中的溶质是硝酸银,化学式为:AgNO3,步骤②的化学反应方程式是:Cu+2AgNO3═Cu(NO3)2+2Ag.(5)由Cu+2AgNO3═Cu(NO3)2+2Ag可知,每64份质量铜反应生成了216分质量的银,反应后溶液的质量变小,所以溶液D的质量大于溶液E的质量.
故答为:(1)Cr>Cu>Ag;(2)漏斗,蒸发;(3)Cr+H2SO4═CrSO4+H2↑;(4)AgNO3,Cu+2AgNO3═Cu(NO3)2+2Ag.(5)大于.
【考点精析】本题主要考查了过滤操作的注意事项和金属材料的选择依据的相关知识点,需要掌握过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属才能正确解答此题.

【题目】某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
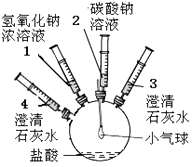
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 | 气球变瘪 |
②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
④将注射器4中的溶液推入瓶中 | 溶液变浑浊 |
(1)步骤①中气球变瘪的原因。
(2)步骤③中气球鼓起的原因。
(3)步骤④中发生反应的化学方程式。