题目内容
【题目】某两个化学兴趣小组做了如下实验:
实验一:设计了一组“吹气球”实验,三套装置如图1:
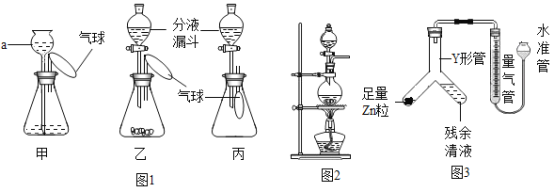
(1)甲装置:
①仪器a的名称为_____。
②甲和乙装置均可以用来制取气体,乙和甲相比,乙的优点是_____。
(2)乙装置:
若实验室用装置制取O2使气球胀大,则反应的化学方程式为_____。
(3)丙装置:欲使气球胀大,分液漏斗中的液体是水,少量水于锥形瓶中则锥形瓶中可能装_____固体(填化学式)。
实验二:用MnO2与浓盐酸反应制备Cl2(发生装置如图2所示,稀盐酸不与MnO2反应)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_____(填序号)。
A 往烧瓶中加入MnO2粉末
B 加热
C 往烧瓶中加入浓盐酸
(2)氯气是一种有毒的气体,可用氢氧化钠溶液来吸收处理,其原理为:Cl2+2NaOH═NaCl+X+H2O,则X的化学式为_____。
A HCl B Cl2 C Na2O D NaClO
(3)利用反应后的残余清液进行实验:装置如图3所示(夹持器具已略去)。
①如何检查该装置的气密性_____。
②反应完些,每间隔1min读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是_____ (排除仪器和实验操作的影响因素)。
【答案】长颈漏斗 可以控制化学反应的速率 2H2O2![]() 2H2O+O2↑ NH4NO3 ACB D 向水准管中注水,直至左右两边管内形成稳定高度差,说明装置不漏气 装置中气体没有冷却到室温,气体在冷却过程中体积逐渐减小
2H2O+O2↑ NH4NO3 ACB D 向水准管中注水,直至左右两边管内形成稳定高度差,说明装置不漏气 装置中气体没有冷却到室温,气体在冷却过程中体积逐渐减小
【解析】
实验一:(1)①仪器a的名称为长颈漏斗;
②甲和乙装置均可以用来制取气体,乙和甲相比,乙的优点是可以控制化学反应的速率;(2)乙装置适用于固液常温下制取氧气,即过氧化氢在二氧化锰的催化作用下分解为水和氧气;化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)欲使气球胀大,分液漏斗中的液体是水,少量水于锥形瓶中,则锥形瓶中可能装的是硝酸铵,因为硝酸铵溶于水会吸收热量造成温度降低,装置内的压强减小,在外界大气压的作用下气球变大;
实验二:(1)添加药品的顺序为先固体后液体,再进行加热;所以顺序为ACB;
(2)根据质量守恒定律,反应前后氢原子都是2个,反应前氯原子是2个,反应后应该是2个,其中1个包含在X中,反应前钠原子是2个,反应后应该是2个,其中1个包含在X中,反应前氧原子是2个,反应后应该是2个,其中1个包含在X中,X的化学式为NaClO;
(3)气密性良好会出现液面差。①连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差,说明装置不漏气;
②反应完毕后,气体体积逐渐减小的原因是:装置中气体没有冷却到室温,气体在冷却过程中体积逐渐减小。