题目内容
在托盘天平的左、右两盘中各放一只烧杯,调节至平衡,向烧杯分别注入等质量、质量分数相同的稀硫酸,然后向两只烧杯中分别加入相同质量的铜铝合金和锌,待物质反应结束后,天平仍保持平衡,合金中铝与铜的质量比为
- A.18∶47
- B.54∶65
- C.27∶64
- D.27∶38
A
试题分析:该题目将化学反应与托盘天平平衡结合在一起,两盘中酸和金属质量相等,完全反应,天平仍平衡则产生氢气相等,由氢气质量求出反应的铝和锌的质量进而求出铜的质量。解:设产生氢气的质量为2g,需要锌的质量为x,需要铝的质量为y,则有
Zn+H2SO4═ZnSO4+H2↑
65 2
x 2g
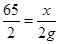 ,解得x=65g
,解得x=65g
2Al+3H2SO4═Al2(SO4)3+3H2↑
54 6
y 2g
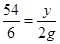 解得y=18g
解得y=18g
∵铜铝合金的质量与锌的质量相等,故铜的质量为65g-18g=47g,
∴铝和铜的质量比为18:47。故选A
考点:本题考查根据化学反应方程式的计算
点评:金属与酸反应后天平平衡的问题是中考常考查的题目,完成此类题目,要分清题干提供的信息,确定是根据酸还是金属的质量进行计算求解。
试题分析:该题目将化学反应与托盘天平平衡结合在一起,两盘中酸和金属质量相等,完全反应,天平仍平衡则产生氢气相等,由氢气质量求出反应的铝和锌的质量进而求出铜的质量。解:设产生氢气的质量为2g,需要锌的质量为x,需要铝的质量为y,则有
Zn+H2SO4═ZnSO4+H2↑
65 2
x 2g
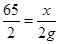 ,解得x=65g
,解得x=65g2Al+3H2SO4═Al2(SO4)3+3H2↑
54 6
y 2g
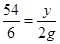 解得y=18g
解得y=18g∵铜铝合金的质量与锌的质量相等,故铜的质量为65g-18g=47g,
∴铝和铜的质量比为18:47。故选A
考点:本题考查根据化学反应方程式的计算
点评:金属与酸反应后天平平衡的问题是中考常考查的题目,完成此类题目,要分清题干提供的信息,确定是根据酸还是金属的质量进行计算求解。

练习册系列答案
相关题目