题目内容
根据碳酸氢铵(NH4HCO3)的分子式计算:(1)碳酸氢铵的相对分子质量
(2)碳酸氢铵中各元素的质量比
(3)1千克碳酸氢铵中的含氢元素的质量与多少千克水中的含氢元素的质量相等?
【答案】分析:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答:解:(1)碳酸氢铵的相对分子质量为:14+1×4+1+12+16×3=79.
(2)碳酸氢铵中氮、氢、碳、氧四种元素的质量比为14:(1×5):12:(16×3)=14:5:12:48.
(3)设需要水的质量为x,则1千克×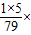 100%=x×
100%=x×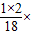 100%,x=0.57kg.
100%,x=0.57kg.
故答案为:(1)79;(2)14:5:12:48;(3)0.57kg.
点评:本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答:解:(1)碳酸氢铵的相对分子质量为:14+1×4+1+12+16×3=79.
(2)碳酸氢铵中氮、氢、碳、氧四种元素的质量比为14:(1×5):12:(16×3)=14:5:12:48.
(3)设需要水的质量为x,则1千克×
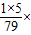 100%=x×
100%=x×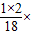 100%,x=0.57kg.
100%,x=0.57kg.故答案为:(1)79;(2)14:5:12:48;(3)0.57kg.
点评:本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
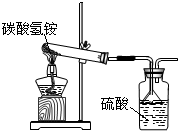 据国家标准,碳铵化肥的NH4HCO3含量不得低少于95%.陈红同学利用图装置和如下反应进行了三次实验,且假设杂质不发生反应.NH4HCO3=NH3↑+H2O+CO2↑;
据国家标准,碳铵化肥的NH4HCO3含量不得低少于95%.陈红同学利用图装置和如下反应进行了三次实验,且假设杂质不发生反应.NH4HCO3=NH3↑+H2O+CO2↑;2NH3+H2SO4═(NH4)2SO4.实验结果如下:
| 实验次数 | 1 | 2 | 3 | 平均值 |
| 使用样品的质量(克) | 8.00 | 8.00 | 8.00 | 8.00 |
| 硫酸溶液增加的质量(克) | 1.71 | 1.69 | 1.70 | 1.70 |
(2)这个结果能否说明这种化肥合格与否,请说明原因.
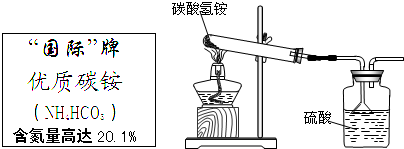
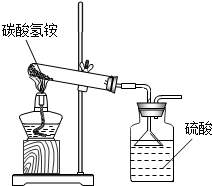 (2013?贵阳模拟)据国家标准,碳铵化肥中NH4HCO3含量不得低于95%.某同学利用如图装置和如下反应进行了三次实验(假设杂质不发生反应):
(2013?贵阳模拟)据国家标准,碳铵化肥中NH4HCO3含量不得低于95%.某同学利用如图装置和如下反应进行了三次实验(假设杂质不发生反应):