题目内容
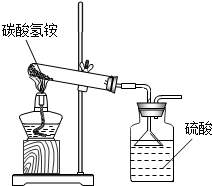 (2013?贵阳模拟)据国家标准,碳铵化肥中NH4HCO3含量不得低于95%.某同学利用如图装置和如下反应进行了三次实验(假设杂质不发生反应):
(2013?贵阳模拟)据国家标准,碳铵化肥中NH4HCO3含量不得低于95%.某同学利用如图装置和如下反应进行了三次实验(假设杂质不发生反应):NH4HCO3
| ||
2NH3+H2SO4═(NH4)2SO4
实验结果如下:
| 实验次数 | 1 | 2 | 3 | 平均值 |
| 使用样品的质量/g | 8.00 | 8.00 | 8.00 | 8.00 |
| 硫酸溶液增加的质量/g | 1.71 | 1.69 | 1.70 | 1.70 |
(2)这个结果能否说明这种化肥合格与否,请说明原因.
分析:(1)假设硫酸溶液增加的质量全是氨气的质量,根据碳酸氢铵分解的化学方程式和氨气的质量,列出比例式,即可计算出参与反应的NH4HCO3质量,然后再根据质量分数公式就可计算出该化肥中碳酸氢铵的百分含量;
(2)根据浓硫酸的性质,即可说明原因.
(2)根据浓硫酸的性质,即可说明原因.
解答:解:(1)设参与反应的NH4HCO3质量为x,
NH4HCO3=NH3↑+H2O+CO2↑
79 17
x 1.7g
=
解之得:x=7.9g;
该化肥中碳酸氢铵的质量分数为:
×100%=98.75%;
(2)这个结果不能说明这种化肥合格,因为浓硫酸有吸水性,在陈红同学的实验中,浓硫酸增加的质量,不一定全部是吸收氨气的质量,也可能还有水的质量.
NH4HCO3=NH3↑+H2O+CO2↑
79 17
x 1.7g
| 79 |
| x |
| 17 |
| 1.7g |
解之得:x=7.9g;
该化肥中碳酸氢铵的质量分数为:
| 7.9g |
| 8.0g |
(2)这个结果不能说明这种化肥合格,因为浓硫酸有吸水性,在陈红同学的实验中,浓硫酸增加的质量,不一定全部是吸收氨气的质量,也可能还有水的质量.
点评:本题主要考查考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
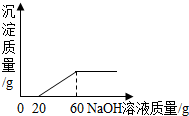 (2013?贵阳模拟)向由40g盐酸和一定质量的氯化铜组成的混合溶液中慢慢滴入20%的氢氧化钠溶液,下列叙述中正确的( )
(2013?贵阳模拟)向由40g盐酸和一定质量的氯化铜组成的混合溶液中慢慢滴入20%的氢氧化钠溶液,下列叙述中正确的( )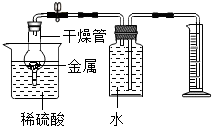 (2013?贵阳模拟)某班级兴趣小组计划对金属与酸反应的情况进实验探究.
(2013?贵阳模拟)某班级兴趣小组计划对金属与酸反应的情况进实验探究.