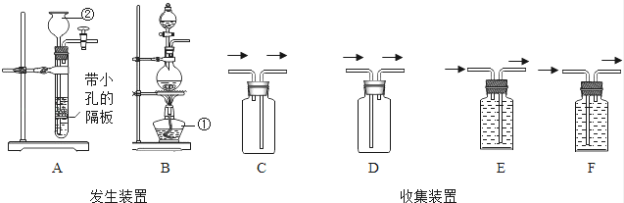
题目内容
【题目】写出下列反应的化学方程式。
(1)纯净的氢气在空气中燃烧__________________;
(2)铁丝在氧气中燃烧________________________;
(3)水在通电的条件下分解________________;
(4)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)在高温下炼铁_______________。
【答案】2H2+O2![]() 2H2O3Fe+2O2
2H2O3Fe+2O2![]() Fe3O42H2O
Fe3O42H2O![]() 2H2↑+O2↑3CO+Fe2O3
2H2↑+O2↑3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
【解析】
正确书写化学方程式的步骤为一写,写出正确的反应物、生成物的化学式并用单线连接;二配,配平方程式中左右两边的原子个数;三标,标明反应条件和必要的气体、沉淀符号。
(1)2H2+O2![]() 2H2O,注意反应条件为点燃,配平化学计量数即可。
2H2O,注意反应条件为点燃,配平化学计量数即可。
(2)3Fe+2O2![]() Fe3O4,注意反应条件为点燃,该反应只发生在纯氧中,生成物为四氧化三铁,配平化学计量数即可。
Fe3O4,注意反应条件为点燃,该反应只发生在纯氧中,生成物为四氧化三铁,配平化学计量数即可。
(3)2H2O![]() 2H2↑+O2↑,注意反应物为液体,生成物为气体,要标注向上气体符号。
2H2↑+O2↑,注意反应物为液体,生成物为气体,要标注向上气体符号。
(4)3CO+Fe2O3![]() 2Fe+3CO2,注意此反应前后均有气体,故不用标注气体符号。
2Fe+3CO2,注意此反应前后均有气体,故不用标注气体符号。

【题目】某校研究性学习小组的同学设计了一个对比实验,探究物质溶于水时是放出热量还是吸收热量。向下图A、B、C三个实验装置中盛有一定量水的小试管里依次加入固体NaCl、NH4NO3、NaOH(加入固体物质之前,三个实验装置中U形管两端的液面持平)。
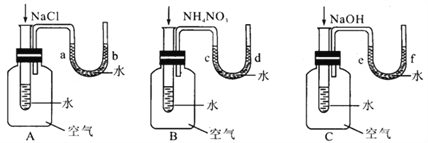
(1)请你帮他们填写下表。
A | B | C | |
现象 | ___________ | ____________ | ___________ |
原因 | __________ | ____________ | ____________ |
(2)从上述物质溶解于水的对比实验中你得出的初步结论是______________。
【题目】某小组同学在用过氧化氢溶液与MnO2制取氧气的过程中,发现反应的速率很慢,产生的气泡很少。为此,他们进行了如下探究:
(猜想与假设)
①速度慢、气泡少可能与过氧化氢溶液的浓度有关。
②速度慢、气泡少可能与MnO2的质量有关。
(进行实验)
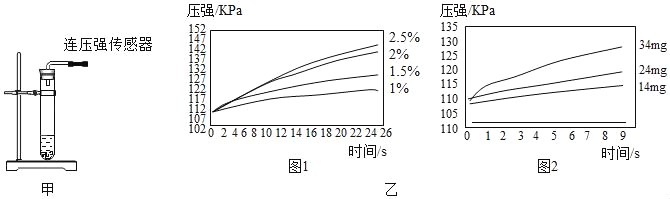
根据图甲进行如下实验。
实验1:用26mg MnO2与5mL不同浓度过氧化氢溶液进行实验,压强变化如乙图1。
实验2:用5mL 1.5%过氧化氢溶液与不同质量MnO2进行实验,压强变化如乙图2。
(解释与结论)
(1)过氧化氢溶液制取氧气的化学方程式为_______________。
(2)实验1得到的结论是___________________________。实验2的目的是_________。
欲得出“MnO2对过氧化氢分解有催化作用”的结论,需要对比____________。(简要的写出实验设想)
(3)小组同学通过互联网得知:多种物质能催化过氧化氢的分解。
(实验探究)
实验证明,CuSO4溶液也能显著加快过氧化氢的分解,CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42﹣ ),稀硫酸中含有三种粒子(H2O、H+、SO42﹣ )为了进一步探究CuSO4,溶液中哪种粒子能起催化作用,小组同学作了以下分析和设计。
①小组同学认为最不可能的是H2O,他们的理由是____________。
②要说明另外的两种粒子是否起到催化作用,小组同学设计了如下实验,完成探究活动。
实验步骤 | 实验现象 | 结论 |
a 取一支试管加入5mL 5%过氧化氢溶液,然后加入2﹣3滴稀硫酸 | 溶液几乎没有 气泡放出 | 验证明,起催化作用的是______。 |
b.另取一支试管加入5mL 5%过氧化氢溶液,然后加入2﹣3滴硫酸铜溶液 | 溶液中有大量气泡放出 |
(反思与评价)
(4)小组同学在进行实验1和2制取氧气过程中,发现反应的速度很慢,产生的气泡很少的原因可能是__________、_________。
(5)利用图甲装置探究“温度对过氧化氢分解速率”的影响,是否合理?_____。理由是________。
【题目】在下表内填写符合要求的化学符号.
符号表示的意义 | 五个氧分子 | 硅元素 | 铁离子 | 氧化锌中锌 元素显正二价 | 四个硫原子 |
化学符号 | ________ | ________ | ________ | ________ | ________ |
【题目】实验室制取氧气并进行相关实验。
①双氧水和二氧化锰制氧气的化学方程式是_______________________。取用二氧化锰操作正确的是___________(选填编号)。

②探究带火星的木条在不同体积分数氧气中的复燃情况,部分实验数据记录如下:
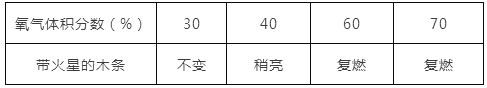
根据上述实验数据得出的结论是___________________________。
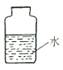
在集气瓶中注入占其容器50%的水(如图所示),用排水法收集氧气,将瓶内的水排尽,用带火星的木条在该集气瓶中进行实验,推测实验现象并说明理由。_________________
③双氧水分解也可用氧化铜作催化剂。在0.5g氧化铜中滴加双氧水,反应结束后固体仍为0.5g且呈_______色。
设计一个实验,证明在双氧水分解反应后,氧化铜化学性质没有发生改变。
步骤 | 现象 | 结论 |
______________ | _______________ | 氧化铜化学性质没有改变 |