题目内容
【题目】甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是
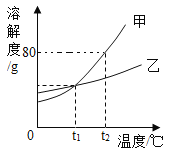
A.甲中含有少量乙时,可直接用过滤法提纯甲
B.t2℃时,将50g甲加入50g水中,可得到90g溶液
C.t1 ℃时,甲、乙的溶液中所含溶质质量相等
D.t1 ℃时,分别将甲、乙的饱和溶液升温至t2℃,所得溶液的溶质质量分数甲=乙
【答案】BD
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
A、甲物质的溶解度受温度变化影响较大,所以甲中含有少量乙时,可用降温结晶法提纯甲,故A错误;
B、t2℃时,甲物质的溶解度是80g,所以将50g甲加入50g水中,可得到90g溶液,故B正确;
C、t1℃时,甲、乙的饱和溶液的质量不能确定,所以饱和溶液中所含溶质质量也不能确定,故C错误;
D、t1℃时,甲、乙物质的溶解度相等,分别将甲、乙的饱和溶液升温至t2℃(水分不蒸发),溶解度增大,溶质、溶剂质量都不变,所得溶液的溶质质量分数:甲=乙,故D正确。
故选BD。

【题目】(一)铁的广泛应用
(1)“加铁酱油”中的铁指的是______ (填字母).
A 单质
B 元素
C 原子
(2)铁制炊具加热食物,说明铁具有的性质是_____ .
(二)草酸亚铁晶体组成的测定
草酸亚铁晶体(化学组成为FeC2O4·xH2O)是一种淡黄色晶体粉末.
(查阅资料)(1)CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉;
(2)FeO和Fe3O4都是黑色物质,FeO在空气中不稳定,易被氧化.草酸亚铁晶体受热分解生成四种氧化物,为确定分解产物及x的值,设计如下实验。
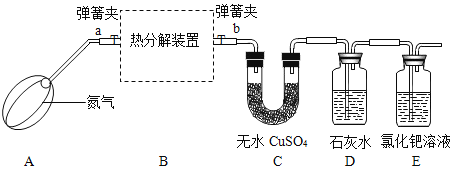
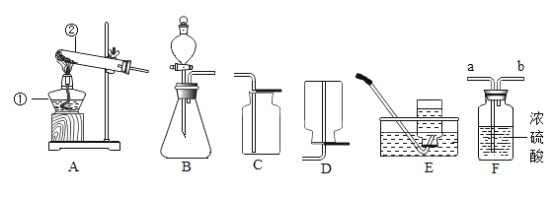
(实验设计)(装置C、D、E中药品均足量)
(小贴士)白色的无水CuSO4吸收水分后变蓝色
(实验步骤)
(1)连接装置,检查________;
(2)称装置C的质量;
(3)在装置B中装入9.0g的草酸亚铁晶体,打开弹簧夹a、b,鼓入一定量氮气;
(4)用酒精灯加热B装置,直至晶体完全变成黑色,停止加热;
(5)继续通氮气至装置冷却,关闭弹簧夹a、b;
(6)再次称量装置B中固体质量、装置C的质量.
(进行实验)该小组同学按上述实验步骤进行实验,并记录了如下数据:
装置B中固体质量(/g) | 装置C的质量(/g) | |
实验前 | 9.0 | 168.2 |
实验后 | 3.6 | 170.0 |
(实验分析及数据处理)
(1)加热前先鼓入一段时间氮气的目的是_______;
(2)实验过程中,装置C中固体变为蓝色,说明草酸亚铁晶体分解生成了_____FeC2O4·xH2O中x的值为___;实验结束后若不继续通氮气,X值将____(填“偏大”、“不变”或“偏小”);
(3)装置D中石灰水变浑浊,说明草酸亚铁晶体分解还生成了_____;
(4)装置E出现黑色物质,说明草酸亚铁晶体分解还生成了_____;同时装置E还具有的作用是吸收___,防止污染大气;
(5)根据上表数据,计算反应后装置B中残留黑色物质的化学式_____;
(6)实验后,装置B中固体的颜色由淡黄色变成黑色,写出草酸亚铁晶体受热分解的化学方程式______;