题目内容
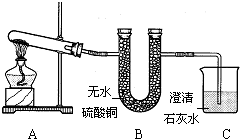 某化学兴趣小组的同学在查阅资料时得知铜绿的主要成分是Cu2(OH)2CO3他们采集了少量的铜绿,利用如图所示的装置进行实验,验证铜绿的元素组成.完全反应后:
某化学兴趣小组的同学在查阅资料时得知铜绿的主要成分是Cu2(OH)2CO3他们采集了少量的铜绿,利用如图所示的装置进行实验,验证铜绿的元素组成.完全反应后:(1)B装置中的无水硫酸铜变蓝;C装置中的澄清石灰水变浑浊.上述现象说明有
水
水
和二氧化碳生成.(2)A装置中绿色的铜绿粉末变成黑色固体,冷却后将此黑色固体与适量的稀硫酸混合,微热,黑色固体溶解形成蓝色溶液,此黑色固体是
氧化铜
氧化铜
;(3)写出铜绿加热反应的化学方程式:
Cu2(OH)2CO3
2CuO+CO2↑+H2O
| ||
Cu2(OH)2CO3
2CuO+CO2↑+H2O
;
| ||
(4)请你推测铜变成铜绿可能是铜和空气中的
氧气、水、二氧化碳
氧气、水、二氧化碳
发生的化学变化.分析:(1)根据无水硫酸铜具有遇水变蓝的性质进行分析解答.
(2)此黑色固体与适量的稀硫酸混合,微热,黑色固体溶解形成蓝色溶液,据此结合酸的化学性质进行分析判断.
(3)碱式碳酸铜在加热条件下生成氧化铜、水和氧化铜,写出反应的化学方程式即可.
(4)根据碱式碳酸铜的组成元素和铜发生锈蚀的条件结合质量守恒定律(反应前后元素的种类不),进行分析解答.
(2)此黑色固体与适量的稀硫酸混合,微热,黑色固体溶解形成蓝色溶液,据此结合酸的化学性质进行分析判断.
(3)碱式碳酸铜在加热条件下生成氧化铜、水和氧化铜,写出反应的化学方程式即可.
(4)根据碱式碳酸铜的组成元素和铜发生锈蚀的条件结合质量守恒定律(反应前后元素的种类不),进行分析解答.
解答:解:(1)无水硫酸铜遇水变蓝,B装置中的无水硫酸铜变蓝,说明有水生成.
(2)铜离子的水溶液显蓝色,该黑色固体能够溶解于稀硫酸且得到蓝色溶液,说明该黑色固体为氧化铜.
(3)碱式碳酸铜在加热条件下生成氧化铜、水和氧化铜,反应的化学方程式为:Cu2(OH)2CO3
2CuO+CO2↑+H2O.
(4)碱式碳酸铜中含有碳、氢、氧、铜四种元素,根据质量守恒定律,反应物中也应该含有这四种元素,除了氧气外,空气中含有碳元素和氢元素的物质为水和二氧化碳;故铜变成铜绿可能是铜和空气中的氧气、水、二氧化碳发生的化学变化.
故答案为:(1)水;(2)氧化铜;(3)Cu2(OH)2CO3
2CuO+CO2↑+H2O;(4)氧气、水、二氧化碳.
(2)铜离子的水溶液显蓝色,该黑色固体能够溶解于稀硫酸且得到蓝色溶液,说明该黑色固体为氧化铜.
(3)碱式碳酸铜在加热条件下生成氧化铜、水和氧化铜,反应的化学方程式为:Cu2(OH)2CO3
| ||
(4)碱式碳酸铜中含有碳、氢、氧、铜四种元素,根据质量守恒定律,反应物中也应该含有这四种元素,除了氧气外,空气中含有碳元素和氢元素的物质为水和二氧化碳;故铜变成铜绿可能是铜和空气中的氧气、水、二氧化碳发生的化学变化.
故答案为:(1)水;(2)氧化铜;(3)Cu2(OH)2CO3
| ||
点评:本题难度不是很大,熟练掌握常见物质的检验方法、质量守恒定律、化学方程式的书写并能灵活运用是正确解答本题的关键.

练习册系列答案
相关题目
 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.


 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.