题目内容
【题目】空气中氧气含量测定再认识. 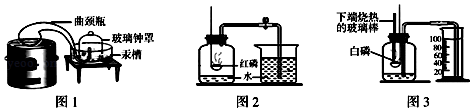
(1)【你知道吗】通过实验(图1)测定了空气组成的科学家是 .
A.门捷列夫
B.达尔文
C.拉瓦锡
D.牛顿
(2)【实验回顾】实验室常用图2所示的方法测定空气中氧气的含量,写出红磷燃烧的化学方程式 . 为保证测定结果,实验中所取红磷必须 .
同学们发现利用图2装置进行实验时,在集气瓶外点燃红磷,一方面会造成空气污染,另一方面伸进集气瓶速度慢了会影响测定结果.他们查阅资料发现白磷40℃即可燃烧,燃烧产物与红磷相同,于是改进装置(图3)重新探究.
(3)【实验探究】先在容积为200.0mL的集气瓶里装进50.0mL的水,再在量筒内装入100.0mL的水,然后按图连好仪器,按下热的玻璃棒,白磷立即被点燃.
①集气瓶里预先装进的水,在实验过程中除了能够加快集气瓶冷却,还起到作用.(写出一种即可)
②如果白磷停止燃烧时立即记录量筒内剩余水的体积,则会导致测定结果(填“偏大”、“偏小”或“不变”).
③如果实验结束时量筒内剩余水的体积是73.0mL,则测得的空气中氧气体积分数为 . (用百分数表示)
(4)【拓展延伸】图4所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来.图5、图6是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强﹣时间关系图(该装置气密性良好,p0是集气瓶内初始气压,p和p′分别是反应结束后恢复到室温时集气瓶内的气压). 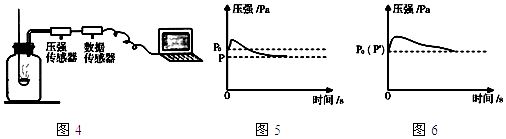
①写出木炭燃烧的化学方程式 . 该实验中能否利用
木炭燃烧测定空气中氧气含量,并说明理由 .
②从微观角度解释图5中反应开始时集气瓶中压强瞬间变大的原因是 .
(5)【交流反思】小明提出能否用铁丝代替上述实验中的红磷测定空气中氧气含量,同学们一致反对,理由是铁丝在空气中不能燃烧.写出铁丝在氧气中燃烧的化学方程式 .
【答案】
(1)C
(2)4P+5O2 ![]() 2P2O5;足量
2P2O5;足量
(3)吸收五氧化二磷;偏小;18%
(4)C+O2 ![]() CO2;不能,是因为木炭在空气中燃烧生成二氧化碳气体;反应放热,导致集气瓶中的微粒之间的间隔变大
CO2;不能,是因为木炭在空气中燃烧生成二氧化碳气体;反应放热,导致集气瓶中的微粒之间的间隔变大
(5)3Fe+2O2 ![]() Fe3O4
Fe3O4
【解析】解:通过实验(图1)测定了空气组成的科学家是拉瓦锡.
故填:C.
【实验回顾】
红磷燃烧的化学方程式为:4P+5O2 ![]() 2P2O5 , 为了保证测定结果,实验中所取红磷必须足量.
2P2O5 , 为了保证测定结果,实验中所取红磷必须足量.
故填:4P+5O2 ![]() 2P2O5;足量.
2P2O5;足量.
【实验探究】集气瓶里预先装进的水,在实验过程中除了能够加快集气瓶冷却,还起到吸收五氧化二磷的作用.故填:吸收五氧化二磷.如果白磷停止燃烧时立即记录量筒内剩余水的体积,由于温度过高而导致进入集气瓶中的水偏少,从而导致测定结果偏小.故填:偏小.如果实验结束时量筒内剩余水的体积是73.0mL,则测得的空气中氧气体积分数为: ![]() ×100%=18%,故填:18%.
×100%=18%,故填:18%.
【拓展延伸】木炭燃烧的化学方程式为:C+O2 ![]() CO2;
CO2;
该实验中不能用木炭燃烧测定空气中氧气含量,这是因为木炭燃烧生成二氧化碳气体,会导致水不能进入集气瓶.故填:C+O2 ![]() CO2;不能,是因为木炭在空气中燃烧生成二氧化碳气体.图5中反应开始时集气瓶中压强瞬间变大的原因是反应放热,导致集气瓶中的微粒之间的间隔变大,从而导致压强增大.故填:反应放热,导致集气瓶中的微粒之间的间隔变大.
CO2;不能,是因为木炭在空气中燃烧生成二氧化碳气体.图5中反应开始时集气瓶中压强瞬间变大的原因是反应放热,导致集气瓶中的微粒之间的间隔变大,从而导致压强增大.故填:反应放热,导致集气瓶中的微粒之间的间隔变大.
【交流反思】铁丝在氧气中燃烧的化学方程式为:3Fe+2O2 ![]() Fe3O4 . 故填:3Fe+2O2
Fe3O4 . 故填:3Fe+2O2 ![]() Fe3O4 .
Fe3O4 .
通过实验(图1)测定了空气组成的科学家是拉瓦锡;
【实验回顾】红磷在空气中燃烧生成五氧化二磷;
【实验探究】五氧化二磷易溶于水;根据提供的数据可以计算空气中氧气的含量;
【拓展延伸】碳燃烧生成二氧化碳气体;铁在空气中不能燃烧,在氧气中燃烧生成四氧化三铁.