题目内容
【题目】实验室以 MnO2 为原料制备少量高纯 MnCO3 的流程如下:
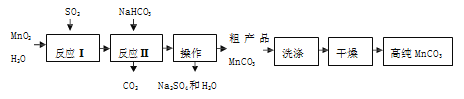
已知:①反应Ⅰ的化学方程式:MnO2+SO2= MnSO4;②MnCO3 难溶于水, MnCO3 在 100℃时开始分解。
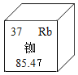
(1)MnSO4 中 Mn 的化合价为______。
(2)流程中“操作”所需要的玻璃仪器有烧杯、玻璃棒、______。
(3)反应Ⅱ的化学方程式为______。
(4)检验 MnCO3 粗产品已洗净:取最后一次洗涤液,加入适量的______(填化学式)溶液,若无明显现象说明已洗净。
(5)为获得高纯 MnCO3,选择“低温干燥”的原因是______。
【答案】+2 漏斗 ![]() BaCl2 防止MnCO3高温分解而影响高纯MnCO3的纯度
BaCl2 防止MnCO3高温分解而影响高纯MnCO3的纯度
【解析】
(1)MnSO4中硫酸根离子显-2价,所以Mn的化合价是+2;
(2)流程中“操作”为将固液分离的操作,为过滤,所需要的玻璃仪器有烧杯、玻璃棒、漏斗;
(3)反应Ⅱ中加入的是反应I的生成物硫酸锰和新加入的碳酸氢钠,生成物为过滤得到的碳酸锰和溶液中的硫酸钠以及生成的气体二氧化碳,故反应Ⅱ为硫酸锰与碳酸氢钠反应生成硫酸钠、碳酸锰、二氧化碳和水,反应的化学方程式为![]() ;
;
(4)验证MnCO3粗产品表面附着有硫酸钠杂质,也就是检验硫酸根的存在:取最后一次洗涤液,加入适量的BaCl2溶液,若无明显现象说明已洗净;
(5)为获得高纯 MnCO3,选择“低温干燥”的原因是MnCO3的分解温度为100℃,为防止MnCO3高温分解而影响高纯MnCO3的纯度。

【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和 他们一起完成以下实验探究。
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式 是______。
(查阅资料)CaC12 滚液显中性
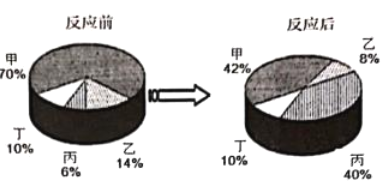
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分 是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想 I:只有 CaC12 猜想 II:有______
猜想 III:有 CaC12 和 Ca(OH)2 猜想 IV:有 CaCl2、HCl 和 Ca(OH)2 乙组同学对以上猜想提出质疑,认为猜想 IV 不合理,其理由是______。
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
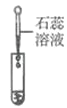
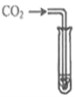
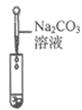
滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 | |
实验操作 |
|
|
|
实验现象 | _______ | _________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想 III 是正确的。
(评价反思)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有 Ca(OH)2,请你帮助他们说明原因______。
【题目】KNO3和KCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
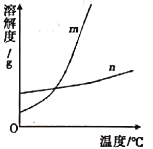
(1)依据上表数据,已绘制出KNO3和KCl的溶解度曲线如图,图中能表示KNO3溶解度曲线的是___(填"m”或“n”)。
(2)由表中数据和如图分析可知,KNO3和KCl在某一温度时具有相同的溶解度s,则s的最小取值范围是_____。
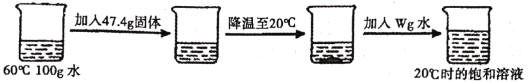
(3)某KNO3晶体中有少量KCl、Ca(OH)2杂质,要得到纯净KNO3的方法是:先加热溶解,然后_______,过滤、洗涤、干燥后得到KNO3晶体。
(4)某同学取KNO3、KCl中的一种物质,按如图所示进行实验。