题目内容
【题目】工业废料石膏(CaSO42H2O)可以“变废为宝”,用于生产氧化钙、硫酸钾、电石(化学名称为碳化钙)等。某研究性学习小组展开了如下系列研究。
一、高纯CaO的制备
【资料一】
Ⅰ.石膏(CaSO42H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物。
Ⅱ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊。
甲同学用如图1装置制备CaO并验证石膏与焦炭高温反应的其他产物。
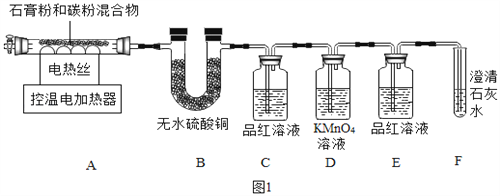
实验过程中发现:B中无水硫酸铜变蓝;C中产生__现象证明有SO2生成;装置__中无明显变化和装置F中__现象证明有CO2生成。写出石膏与碳粉在高温条件下反应的化学方程式:____。
二、硫酸钾和电石的制备
乙同学模拟生产化肥硫酸钾和电石的流程如图2:
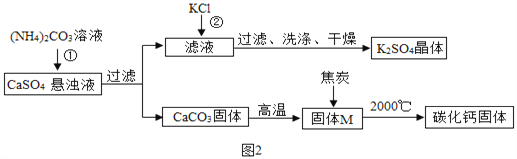
【资料二】CaO与C在高温下反应生成碳化钙(化学式为CaCx)和CO。
(1)反应①的化学方程式为___。证明固体M中不含CaCO3的方法是____(写出实验的方法、现象)。
(2)反应②的化学方程式为(NH4)2SO4+2KCl═K2SO4↓+2NH4Cl,该反应能析出K2SO4晶体的原因是__。
三、假设上述流程中制得的碳化钙(化学式为CaCx)固体中只含杂质CaO,乙小组同学为测定CaCx中x的值进行如下实验。
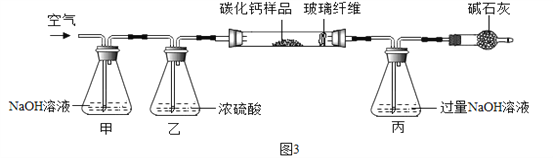
【资料三】CaCx在空气中灼烧生成CaO和CO2。
步骤一:称取3.76g样品于图3所示石英管中(测定装置图如图3,夹持及加热装置省略),反应前缓缓通入空气,高温灼烧石英管中的样品至反应完全后继续缓缓通入空气,测得丙溶液的质量比反应前增重了4.4g。(玻璃纤维可防止固体粉末进入导管)
步骤二:将石英管内剩余固体全部转移到水中,加入足量碳酸钠溶液,经搅拌、过滤、洗涤、干燥等操作得到碳酸钙固体6克。试回答下列问题:
(1)装置甲的作用是__。反应完全后继续缓缓通入空气的目的是__。
(2)根据步骤一、二计算该样品中钙、碳、氧的质量比为___,
计算确定CaCx的化学式(请写出计算过程)______________。
(3)若碳酸钙未能完全干燥,则会导致CaCX中的x的值____(填“偏大”、“偏小”、“无影响”)。
【答案】 品红溶液褪色 E 出现浑浊 2CaSO4·2H2O + C ![]() 2CaO + CO2↑+ 2SO2↑+ 4H2O↑ CaSO4 + (NH4)2CO3 ===CaCO3↓+ (NH4)2SO4 取少量固体,加入稀盐酸,无气泡生成,则无碳酸钙 相同温度下,K2SO4的溶解度小 除去通入空气中的CO2气体 将生成的CO2完全排入丙装置中吸收 【答题空10】30:15:2 CaC2 偏小
2CaO + CO2↑+ 2SO2↑+ 4H2O↑ CaSO4 + (NH4)2CO3 ===CaCO3↓+ (NH4)2SO4 取少量固体,加入稀盐酸,无气泡生成,则无碳酸钙 相同温度下,K2SO4的溶解度小 除去通入空气中的CO2气体 将生成的CO2完全排入丙装置中吸收 【答题空10】30:15:2 CaC2 偏小
【解析】一、高纯CaO的制备
实验过程中发现:B中无水硫酸铜变蓝(说明生成了水)。根据信息提示“SO2能使品红溶液褪色”,而结论是证明有二氧化硫生成,所以对应的现象为C中的品红溶液褪色现象,装置D是吸收二氧化硫,而导致高锰酸钾褪色.E装置的作用是证明二氧化硫已经完全被吸收,后面若石灰水变浑浊,则是二氧化碳所致,而非二氧化硫,所以证明二氧化碳生成的现象是装置 E中无明显变化(无二氧化硫的干扰)和装置F中 澄清石灰水变浑浊现象(有二氧化碳),碳粉在高温条件下生成氧化钙、水、二氧化碳和二氧化硫,对应的化学方程式为2CaSO42H2O+C ![]() 2CaO + CO2↑+2SO2↑+ 4H2O↑;
2CaO + CO2↑+2SO2↑+ 4H2O↑;
二、硫酸钾和电石的制备
(1)反应①是碳酸铵和硫酸钙反应生成碳酸钙和硫酸铵,对应的化学方程式为 CaSO4+(NH4)2CO3═CaCO3↓+(NH4)2 SO4.由于碳酸盐遇到盐酸会生成气体,所以要证明固体M中不含CaCO3的方法是取样,加入足量稀盐酸,无气泡冒出;
(2)反应②的化学方程式为(NH4)2SO4+2KCl═K2SO4↓+2NH4Cl,由于硫酸钾标注了沉淀符号,而已有的知识是硫酸钾可溶,说明在给定物质中溶解度相对最小,所以该反应能析出K2SO4晶体的原因是该温度下,K2SO4的溶解度小;
三、实验设计是通过通入不含二氧化碳的空气(避免对后期生成的二氧化碳的质量的干扰),将碳化钙样品转化为氧化钙和二氧化碳,然后将生成的二氧化碳用丙装置完全吸收,也就是装置丙的质量增加就是生成的二氧化碳,为将二氧化碳完全吸收而避免残留于试管中,所以在反应完全后应该继续通入除去了二氧化碳的空气。右侧的碱石灰是避免右侧的空气进入装置内导致二氧化碳等被吸收,影响实验结果的准确性;
所以:
①装置甲的作用是 除去空气中的CO2气体。反应完全后继续缓缓通入空气的目的是 使残留在装置内的CO2气体被丙装置充分吸收;
②碳元素的质量为4.4g×![]() ×100%=1.2g,钙元素的质量为6g×
×100%=1.2g,钙元素的质量为6g×![]() ×100%=2.4g,则氧元素的质量为3.76g-1.2g-2.4g=0.16g,该样品中钙、碳、氧的质量比为2.4g:1.2g:0.16g=30:15:2;
×100%=2.4g,则氧元素的质量为3.76g-1.2g-2.4g=0.16g,该样品中钙、碳、氧的质量比为2.4g:1.2g:0.16g=30:15:2;
对应的氧化钙的质量为0.16g÷( ![]() ×100%)=0.56g,则氧化钙中的钙元素的质量为0.56g-0.16g=0.4g;
×100%)=0.56g,则氧化钙中的钙元素的质量为0.56g-0.16g=0.4g;
对应的碳化钙中的钙元素的质量2.4g-0.4g=2g,则碳化钙中钙原子和碳原子的个数比为![]() =1:2;
=1:2;
所以CaCx的化学式CaC2;
(3)若碳酸钙未能完全干燥,则钙元素的质量会偏高,会导致CaCX中的x的值偏小。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】某班同学在做《基础实验8》中碱的化学性质时,发现将NaOH固体溶于水后的溶液与CuS04溶液反应时出现了三种实验现象:蓝色絮状沉淀、浅绿色沉淀、亮蓝色溶液。产生蓝色絮状沉淀时的反应方程式为_______________________________________。对于异常实验现象,
同学们展开研究性学习。
【提出问题】实验中产生异常现象的原因是什么?
【初步探究】甲同学将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中。实验现象如下:
滴加CuSO4溶液的量 | 实验现象 |
第1~6滴 | 产生蓝色沉淀,振荡后沉淀消失,形成亮蓝色溶液。 |
第7~9滴 | 产生蓝色沉淀,振荡后沉淀不消失,沉淀逐渐增多。 |
第10~20滴 | 蓝色沉淀不再增加,振荡后沉淀逐渐变为浅绿色。 |
【实验结论】_____________________________是实验出现“异常”的主要因素。
【再次探究】两种异常现象产物是什么?
【查阅资料】
①碱式硫酸铜是一种浅绿色固体,化学式可表示为aCuSO4·bCu(OH)2难溶于水,在酸溶液中可发生反应生成Cu2+、SO42—和H2O。加热时能分解生成氧化铜、非金属氧化物和氧气。
②铜酸钠[Na2Cu(OH)4]能溶于水,溶液呈亮蓝色。该溶液不稳定,久置或加热易生成氧化铜沉淀。
③碱式硫酸铜、氢氧化铜、铜酸钠之间可逐步转化。
【猜想假设】
Ⅰ.Cu(OH)2在NaOH溶液中溶解生成铜酸钠。
Ⅱ.实验中形成浅绿色沉淀是碱式硫酸铜。
【实验探究】
Ⅰ.乙同学向Cu(OH)2中加入过量饱和NaOH溶液,沉淀溶解,滴加少量稀硫酸,出现黑色沉淀。
Ⅱ.丙同学取出实验中浅绿色固体,分成等质量两份,一份高温灼烧后只得到1.6gCuO固体,另一份滴加10%的稀盐酸至恰好完全反应,共用去盐酸10.95g。
【结论解释】猜想Ⅰ成立。出现黑色沉淀原因是________________________________。
猜想II成立。a:b=________________。
【实验反思】丁同学按照书本要求向2mLCuSO4溶液中逐滴加入稀氢氧化钠溶液,始终未形成亮蓝色溶液,说明实验现象还与______________________有关,实验时要遵守实验要求。