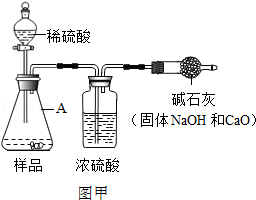
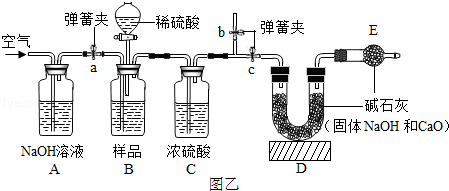
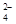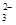题目内容
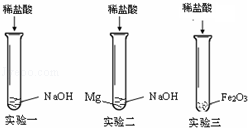
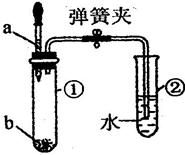
善于探究问题的小华用下图所示装置进行了多组实验,观察到试管②中先有气泡冒出,一段时间后在导管中形成一段水柱。则试管①中加入的a、b物质不可能为:

| A.水和氢氧化钠固体 |
| B.稀硫酸和镁条 |
| C.水和硝酸铵 |
| D.稀盐酸和生石灰 |
C
试题分析:这个实验的设计比较新颖,用实验的形式来考核学生对放热反应及吸收反应的理解,我们必须通过现象看到本质。②中先有气泡冒出是因为试管①中反应放热,气体膨胀所致,一段时间后②中导管中形成一段水柱,说明是试管①温度降低。冷却后气压减少的结果。因此,A、B、D三个选项涉及的反应都是放热的,之后反应完全温度降低、逐渐冷却,就会出现题目告知的②中的现象。而C答案的硝酸铵在水中溶解,这是吸热的,故试管①中不会有气泡冒出的。故选择答案C。
点评:从实验现象看到本质,从而理解反应的取舍。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目