题目内容
用 Y形管或 Y 形导管完成以下实验。
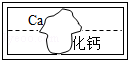
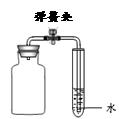
(1)图9中Y形管左侧管中加入无色酚酞试液,右侧管中加入浓氨水,一段时间后,可观察到的现象:________________________,用分子的观点解释这一现象:________________________。
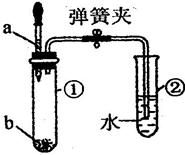
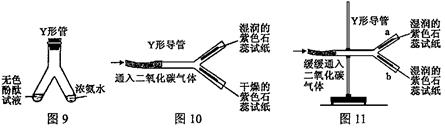
(2)图10 中 Y 形导管平放于桌面,实验中可观察到的现象;________________________,用化学方程式解释结论:________________________;若把Y形导管固定在铁架台上(如图 11 ) , a 管位于上方, b 管位于下方,两石蕊试纸均湿润,可观察到 b 管中试纸变色比a 管明显,原因:________________________。

(1)图9中Y形管左侧管中加入无色酚酞试液,右侧管中加入浓氨水,一段时间后,可观察到的现象:________________________,用分子的观点解释这一现象:________________________。
(2)图10 中 Y 形导管平放于桌面,实验中可观察到的现象;________________________,用化学方程式解释结论:________________________;若把Y形导管固定在铁架台上(如图 11 ) , a 管位于上方, b 管位于下方,两石蕊试纸均湿润,可观察到 b 管中试纸变色比a 管明显,原因:________________________。
(1)无色酚酞变红色,分子的不断运动
(2)湿润的紫色石蕊试纸变红色,干燥的紫色石蕊试纸无明显变化
H2O+CO2=H2CO3;二氧化碳的密度比空气大,主要从b管中通过。
(2)湿润的紫色石蕊试纸变红色,干燥的紫色石蕊试纸无明显变化
H2O+CO2=H2CO3;二氧化碳的密度比空气大,主要从b管中通过。
CO2 是一种无色无味的气体,其密度比空气的大。CO2能使润湿的石蕊试纸变红,其原因是H2O+CO2=H2CO3,H2CO3使紫色石蕊变红,并不是CO2 。

练习册系列答案
相关题目