题目内容
【题目】我国青海湖采集的天然碱样品可表示为aNa2CO3·bNaHCO3·cH2O(a、b、c为最简整数比)。某实验小组为测定其组成,称取该天然碱样品16.6g进行如下实验:
资料Ⅰ:碳酸氢钠不稳定,加热易分解为碳酸钠、二氧化碳和水,而碳酸钠比较稳定,加热时不分解 ;
资料Ⅱ:图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭。
资料Ⅲ:装置C、F、G中都是碱石灰(CaO与NaOH的固体混合物)
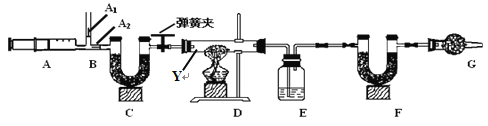
【实验步骤】 ①连接好装置,先 ;②反复推拉注射器;③称量E、F的质量;④关闭弹簧夹,加热D处试管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量E、F的质量。
【问题探究】
(1)仪器Y的名称是 ;
(2)实验步骤①连接好装置,先 ;
(3)E中的药品为 (填名称),目的是 ,F的作用是 ,G的作用是 ;
(4)实验步骤②与③能否颠倒 (填“能”或“不能”)。若无装置C,则所测得的碳酸氢钠质量分数 (填“偏大”、“偏小”、“无影响”)。若不进行步骤⑤的操作,则所测得的碳酸氢钠质量分数 (填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是 。
(5)写出装置D中发生的化学反应化学方程式 (计量数用abc表示)
(6)通过右表数据,求得该天然碱化学式中a:b:c = 。(写出过程)
反应前 | 反应后 | |
装置E的质量/g | 100.0 | 102.25 |
装置F的质量/g | 50.0 | 51.1 |
【答案】(1)硬质玻璃管(2)检查装置的气密性(3)浓硫酸 吸收水蒸气 吸收生成的二氧化碳 防止空气中的二氧化碳和水蒸气被F吸收(4)不能 偏大 偏小 使残留在装置中的二氧化碳和水蒸气充分被吸收
(5)aNa2CO3·bNaHCO3·cH2O![]() (a+b/2)Na2CO3+(b/2+c)H2O+b/2CO2↑
(a+b/2)Na2CO3+(b/2+c)H2O+b/2CO2↑
(6)2:1:2
【解析】
试题分析:①连接好装置,先检查装置的气密性,防止漏气;E中的药品为浓硫酸,目的是吸收水分,是一种干燥剂,F的作用是吸收二氧化碳,G的作用是防止空气中的二氧化碳和水蒸气被F吸收;实验步骤②与③不能否颠倒。若无装置C,则所测得的碳酸氢钠质量分数偏大。若不进行步骤⑤的操作,则所测得的碳酸氢钠质量分数偏小,该操作中推注射器时缓缓的目的是使残留在装置中的二氧化碳和水蒸气充分被吸收,D中发生的化学反应化学方程式aNa2CO3·bNaHCO3·cH2O = (a+b/2)Na2CO3 + (b/2+c)H2O + b/2 CO2↑
生成的水的质量m=102.25g–100.0g=2.25g
生成的二氧化碳质量=51.1g–50.0g=1.1g
设NaHCO3质量为x,其分解产生的水的质量为y
2NaHCO3==Na2CO3+H2O+CO2↑
168 18 44
x y 1.1g
列比例式得:168:X=18:Y=44:1.1克
解得x=4.2g y=0.45g
m(结晶水)=2.25g—0.45g=1.8g
m(Na2CO3)=16.6g—4.2g—1.8g=10.6g
a:b:c=10.6克/106:4.2克/84:1.8克/18=2:1:2



