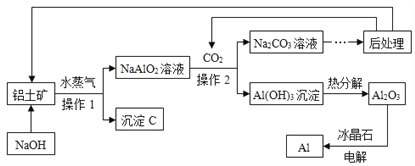
题目内容
【题目】在实验室里称量一定质量的Na2CO3放入烧杯中,加入一定质量分数的稀硫酸100 g,恰好完全反应,共生成2.2 g的CO2气体(假设产生的气体完全逸出,水的挥发忽略不计)。已知实验中发生的化学反应:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
(1)Na2CO3样品的质量为_________________g。
(2)100 g稀硫酸的溶质质量分数为_______________(写出计算过程)。
(3)反应后烧杯中溶液的溶质质量分数为______________(写出计算过程,结果精确到0.1%)。
【答案】 5.3 4.9% 6.9%
【解析】本题考查了结合溶液溶质质量分数的化学方程式计算。
设:样品中碳酸钠的质量为x,参加反应的硫酸质量为y,同时生成硫酸钠的质量为z。
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 98 142 44
x y z 2.2g
![]() =
=![]() x=5.3g
x=5.3g
![]() =
=![]() y=4.9g
y=4.9g
![]() =
=![]() z=7.1g
z=7.1g
稀硫酸的溶质质量分数为=![]() ×100%=4.9%
×100%=4.9%
反应后烧杯中溶液的溶质质量分数=![]() ×100%=6.9%
×100%=6.9%
答:(1)Na2CO3样品的质量为5.3g。
(2)100 g稀硫酸的溶质质量分数为4.9%。
(3)反应后烧杯中溶液的溶质质量分数为6.9%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目