题目内容
【题目】实验室现有下列仪器及部分药品(药品自选),请回答下列问题:
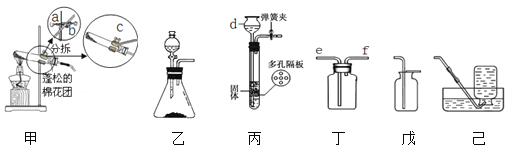
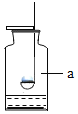
(1)仪器⑧的名称为_______________。
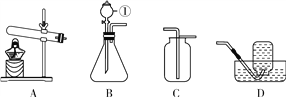
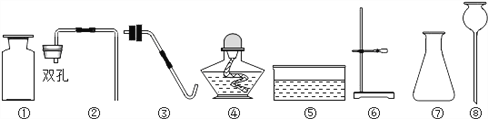
(2)利用上述仪器可以制取二氧化碳,你选择的仪器是________(填序号),反应的化学方程式为_____。
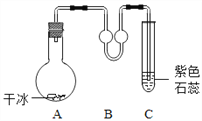
(3)常温下进行如下图所示实验。A 中固体逐渐减 少,发生__________(选填“物理”或“化学”)变 化。C 中有气泡,溶液颜色____。
(4)有同学称取了一定质量的铜锌合金样品,加入 到盛有 146.0g 稀盐酸的烧杯中,发现两者恰好完全反应(杂质不参加反应),且反应后烧杯内物质总质 量减少了 0.3g,请问该稀盐酸中溶质的质量分数为多少?__________(写出计算过程)。
【答案】 长颈漏斗 ①②⑦⑧ CaCO3+2HCl=CaCl2+H2O+CO2↑ 物理 变红 7.5%
【解析】(1)仪器⑧的名称为长颈漏斗;
(2)实验室制取二氧化碳的反应物的状态是固体和液体,反应的条件是不加热,故选固液不加热型装置组合为:①②⑦⑧;该反应是由碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑ ;
(3)A中固体是固态的二氧化碳,易升华变为气态的二氧化碳,该变化过程中没有新物质的生成,是物理变化;二氧化碳与石蕊溶液中的水反应生成碳酸,碳酸使紫色的石蕊溶液变为红色;
(4)反应后烧杯内物质总质量减少了 0.3g,说明生成氢气的质量为0.3g;
设生成0.3g氢气需要盐酸溶质的质量为x
Zn+2HCl==ZnCl2+H2↑
73 2
X 0.3g
![]() =
=![]()
x=10.95g
该稀盐酸中溶质的质量分数为![]() =7.5%
=7.5%
答:该稀盐酸中溶质的质量分数为7.5%。

练习册系列答案
相关题目