题目内容
【题目】为了测定某铜锌混合物中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
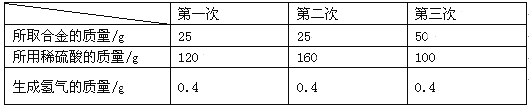
①每一次反应中生成氢气的物质的量是 (1) 。
②试计算该铜锌合金中锌的质量分数(写出计算过程)。 (2)
③从上表数据分析,当所取合金与所用稀硫酸的质量比为 (3) 时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应。
【答案】(1)0.2mol (2)52%; (3)1:4
【解析】
试题分析:①每一次反应中生成氢气的物质的量是为0.4g/2g/mol=0.2mol
(2)设Zn的物质的质量为xmol。
Zn + H2SO4 → ZnSO4 + H2↑
1 1
X 0.2
X= 0.2(mol)
Zn%=0.2×65/25=52%
(3)25g︰100g=1︰4。

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目






