题目内容
【题目】 图中的物质均是初中化学常见物质,其中A是常见的无色液体,F是大理石的主要成分,甲是生活里常用的燃料。根据它们之间的转化关系(有些反应条件、反应物、生成物已省略)。回答下列问题:

(1)D→E的化学方程式是:________;
(2)F→D的化学方程式是___________,该反应的基本类型
【答案】(1) CO2+2NaOH=Na2CO3+H2O等(2) CaCO3+2HCl=CaCl2+H20+CO2↑ 复分解反应
【解析】
试题分析:A是常见的无色液体,说明A是水,水通电会产生氧气和氢气,甲是一种常用燃料,说明B是氧气,F是大理石的主要成分,说明F是碳酸钙,甲是生活里常用的燃料,说明甲是甲烷。 带入后符合题意。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】石膏法制取硫酸钾具有能耗低,原料来源广等优点而被探索。以硫酸钙与氯化钾为原料制备硫酸钾的流程如下:
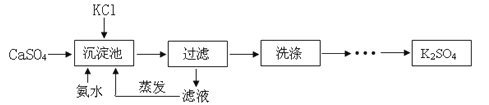
已知硫酸钾在不同温度下在水溶液、氨溶液中的溶解度(g)
温度(℃) | 0 | 10 | 26 | 30 |
水溶液 | 7.31 | 9.28 | 11.03 | 12.98 |
氨(8%)溶液 | 1.41 | 1.58 | 2.25 | 3.36 |
氨(35%)溶液 | 0.44 | 0.75 | 0.82 | 非常压 |
(1)氨水显 (填“酸性”、“碱性”或“中性”),向水中连续通氨气达两个小时可得高浓度氨水,氨气不断溶解使溶液pH (填“增大”、“减小”或“不变”)。上表中“非常压”指需增大气压才能形成30℃的氨(35%)溶液,常压下不能形成30℃的氨(35%)溶液的原因是 。
(2)沉淀池中氨水浓度常常控制在25%至40%,其原因是 ,沉淀池温度适宜保持在
(选填“低温”或“高温”)。
(3)滤液经蒸发后产生可以循环使用的气体,其化学式为 ;滤液中的副产品氯化钙可转化成碳酸钙固体,与HNO3反应制备Ca(NO3)2·6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸溶液中溶质与溶剂的质量比为 。
(4)实验室进行过滤操作需要的玻璃仪器有烧杯、玻璃棒、 ,其中玻璃棒在稀释浓硫酸时也用到,稀释浓硫酸时用到玻璃棒的主要作用为 。
(5)检验沉淀是否洗净的试剂是 (填序号)
A.酚酞试液 B碳酸钠溶液 C氯化钡溶液


