题目内容
【题目】碳酸钠和碳酸氢钠是生活中常见的两种白色固体.同学们对鉴别这两种物质非常感兴趣,进行如下探究.
【查阅资料】
①碳酸钠和碳酸氢钠在不同温度下的溶解度
10℃ | 20℃ | 30℃ | 40℃ | |
Na2CO3 | 12.5 g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
②碳酸钠和碳酸氢钠化学性质(部分)的比较
性质 | Na2CO3 | NaHCO3 | 性质比较 |
溶液的酸碱性 | 碱性 | 碱性 | 相铜条件下,Na2CO3溶液的碱性更强 |
热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2CO3、CO2 和H2O |
与盐酸反应 | 反应 | 反应 | 均产生CO2 , 但NaHCO3与盐酸的反应更加剧烈 |
(1)【设计方案并实施】
实验方案 | 实验现象及结论 1 |
方案一:。 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
方案二:分别将两种待测固体溶于水制成5%的溶液,。 | pH值大的为碳酸钠溶液,pH值小的为碳酸氢钠溶液. |
方案三:分别取少量固体于試管中加热,将产生的气体通入澄清的石灰水中. | 。 |
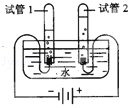
方案四:如阁所示,分别将气球中的白色固体全部且同时倒入装有盐酸的试管中,观察现象. | 。 |
(2)【实验反思】
通过上述实验,我们了解依据物质的性质设计并进行实验,能帮助我们更好地理解和掌握相关物理的性质.
【答案】
(1)20℃时,在100 g水中加入11 g该白色固体,充分溶解;用玻璃棒分别蘸取少量待测液于pH试纸上,静置,观察现象;若石灰水变浑浊,样品为碳酸氢钠,否则为碳酸钠.;气球胀大速度快且大的,原固体为碳酸氢钠,否则为碳酸钠
(2)对比
【解析】解:可利用碳酸钠和碳酸氢钠在不同温度下的溶解度;碳酸钠与盐酸反应时会先生成碳酸氢钠而不会马上产生二氧化碳气体、碳酸氢钠受热能分解出气体二氧化碳或两物质所得溶液的酸碱性强弱有明显差异等性质,分别进行滴加盐酸、加热或测溶液pH等对比实验,进行鉴别;则:【设计方案并实施】
实验方案 | 实验现象及结论 1 |
方案一:20℃时,在100g水中加入11g该白色固体,充分溶解 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
方案二:分别将两种待测固体溶于水制成5%的溶液,用玻璃棒分别蘸取少量待测液于pH试纸上,静置,观察现象 | pH值大的为碳酸钠溶液,pH值小的为碳酸氢钠溶液. |
方案三:分别取少量固体于試管中加热,将产生的气体通入澄清的石灰水中. | 若石灰水变浑浊,样品为碳酸氢钠,否则为碳酸钠. |
方案四:如阁所示,分别将气球中的白色固体全部且同时倒入装有盐酸的试管中,观察现象. | 气球胀大速度快且大的,原固体为碳酸氢钠,否则为碳酸钠 |
【实验反思】
通过上述实验,我们了解依据物质的性质设计并进行对比实验,能帮助我们更好地理解和掌握相关物理的性质.
所以答案是:
实验方案 | 实验现象及结论 |
方案一:20℃时,在100g水中加入11g该白色固体,充分溶解. | |
方案二:用玻璃棒分别蘸取少量待测液于pH试纸上,静置,观察现象. | |
若石灰水变浑浊,样品为碳酸氢钠,否则为碳酸钠. | |
气球胀大速度快且大的,原固体为碳酸氢钠,否则为碳酸钠. |
【实验反思】对比

【题目】NaCl和KNO3在不同温度时的溶解度如表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
下列说法正确的是( )
A.10℃时,将40g NaCl固体加入100g水中,可得到140gNaCl溶液
B.40℃KNO3溶液溶质质量分数一定比NaCl溶液溶质质量分数大
C.将30℃的KNO3饱和溶液升温至60℃,会变成不饱和溶液
D.20℃时,NaCl饱和溶液的溶质质量分数为36%