题目内容
【题目】下列叙述正确的是( )
①分子是保持物质性质的一种粒子;②原子是不能再分的最小粒子;③最外层电子数小于4的原子一定是金属原子;④最外层电子数为8的粒子一定是稀有气体原子; ⑤化学变化中分子一定要分
A. ①④ B. ②⑤ C. ④⑤ D. ⑤
【答案】D
【解析】①分子是保持物质化学性质的一种粒子,错误;②原子可以再分为原子核和核外电子,错误;③最外层电子数小于4的原子不一定是金属原子,例如氢原子,错误;④最外层电子数为8的粒子不一定是稀有气体元素的原子,可能是原子得失电子形成的离子,错误;⑤化学变化的实质是反应物的分子分成原子,原子重新组合成新的分子,正确。故选D。

【题目】碳酸钠和碳酸氢钠是生活中常见的两种白色固体.同学们对鉴别这两种物质非常感兴趣,进行如下探究.
【查阅资料】
①碳酸钠和碳酸氢钠在不同温度下的溶解度
10℃ | 20℃ | 30℃ | 40℃ | |
Na2CO3 | 12.5 g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
②碳酸钠和碳酸氢钠化学性质(部分)的比较
性质 | Na2CO3 | NaHCO3 | 性质比较 |
溶液的酸碱性 | 碱性 | 碱性 | 相铜条件下,Na2CO3溶液的碱性更强 |
热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2CO3、CO2 和H2O |
与盐酸反应 | 反应 | 反应 | 均产生CO2 , 但NaHCO3与盐酸的反应更加剧烈 |
(1)【设计方案并实施】
实验方案 | 实验现象及结论 1 |
方案一:。 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
方案二:分别将两种待测固体溶于水制成5%的溶液,。 | pH值大的为碳酸钠溶液,pH值小的为碳酸氢钠溶液. |
方案三:分别取少量固体于試管中加热,将产生的气体通入澄清的石灰水中. | 。 |
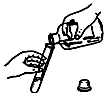
方案四:如阁所示,分别将气球中的白色固体全部且同时倒入装有盐酸的试管中,观察现象. | 。 |
(2)【实验反思】
通过上述实验,我们了解依据物质的性质设计并进行实验,能帮助我们更好地理解和掌握相关物理的性质.