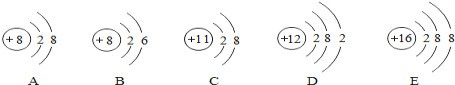题目内容
【题目】水是人类生活中不可缺少的物质。
(1)下列净水方法中,净水程度最高的是_____
A.过滤B.煮沸C.蒸馏 D.吸附
(2)自来水厂常用二氧化氯(ClO2)消毒,其中氯元素的化合价为________。
(3)小花同学设计了电解水简易装置,其中A、B电极由金属曲别针制成。通电后的现象如图所示,则与A电极直接相连的是电源的_____极。该实验常常在水中加入少量稀硫酸或氢氧化钠,目的是_____。
(4)电解水的化学方程式为________。
(5)使用硬水会给生活和生产带来许多麻烦,区分硬水与软水的方法是分别加入________。
【答案】C +4 正 增强水的导电性 2H2O ![]() 2H2↑ + O2↑ 肥皂水
2H2↑ + O2↑ 肥皂水
【解析】
(1)在水的净化过程中,自然沉降,是重力的作用下,水中的较大的、重的不溶物下沉;吸附沉降即化学沉降,是利用明矾在水中形成絮状物质,使悬浮颗粒聚集而沉降;过滤除掉沉降还不能除掉的小颗粒不溶物;蒸馏是加热到水的沸点使水从混合物中蒸发出来,然后再被冷凝成液态的水,得到的蒸馏水是纯净物。其中净化程度最高的方法是蒸馏,选C;
(2)化合物中元素的化合价代数和为零,自来水厂常用二氧化氯(ClO2)消毒,其中氧元素显-2价,氯元素的化合价为+4;
(3)电解水时,正极生成的是氧气,负极生成氢气,氢气是氧气体积的2倍;根据通电后的现象,则与A电极直接相连的是电源的正极。该实验常常在水中加入少量稀硫酸或氢氧化钠,目的是增强水的导电性,因为硫酸或氢氧化钠在水中电离产生离子;
(4)水在通电条件下生成氢气和氧气,化学方程式为2H2O ![]() 2H2↑ + O2↑ ;
2H2↑ + O2↑ ;
(5)区分硬水与软水的方法是分别加入肥皂水,泡沫多、浮渣少的为硬水,反之,为软水。

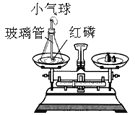
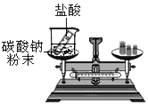
【题目】为了探究化学反应前后各物质的总质量是否发生改变,甲、乙、丙三组同学分别进行了下列实验,请根据图示回答问题。
[实验探究]甲、乙、丙三组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | 丙组 | |
实验装置 |
|
|
|
⑴甲组同学的实验现象是红磷燃烧,产生大量_______;小气球先膨胀,冷却后变得更瘪;反应后冷却到室温称量,天平的指针_______(填:“向右”、“向左”或“不”)偏转。在该实验中,玻璃管上系一个小气球的目的是________。该反应的化学方程式为_______。
⑵乙组同学的实验现象是铁钉表面有红色固体析出,溶液变为________色,反应前、后天平保持平衡。该反应的化学方程式为________。
⑶丙组同学的实验现象是反应剧烈,产生大量气泡,反应后天平不保持平衡。
[实验结论]化学反应前后各物质的总质量不发生改变。
[实验反思]在探究化学反应前后各物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在________装置中进行。