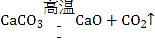题目内容
【题目】小东和几位同学在实验室选用了如下几种装置来制取气体。
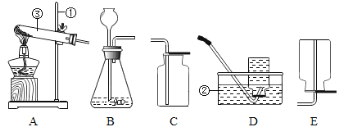
(1)填出图中有①②③的仪器的名称。①_______________②_______________③_____________。
(2)小东用过氧化氢和二氧化锰来制取氧气,他应选择的发生装置为______,反应的符号表达式为_____________。可选用装置_____(填写装置序号)能收集到较纯净的氧气。
(3)小娟用高锰酸钾来制取氧气,他应选择的发生装置为____,他采用排水法收集氧气,结果发现水槽中的水变红了,请你帮他分析一下原因:___________________。实验结束时,要先把导管移出水面,后停止加热,其理由是_________________;导管口开始冒气泡为何不能马上收集__________________。
(4)小夏用氯酸钾和二氧化锰来制取氧气,他应选择的发生装置为____。其反应的符号表达式为___________________。其基本反应类型为________________。
(5)若收集某气体时只能选用E装置,则可推知该气体的性质可能有______________。
(6)氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,氨水显碱性。实验室里加热氯化氨和熟石灰两种固体的混合物可制取氨气。最好选用哪种气体制取装置和收集装置_______ 。(选序号)
【答案】铁架台 水槽 试管 B 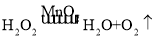 D A 试管口没有塞棉花 防止水槽中的水沿导管进入试管,使试管炸裂 开始出来的气体中存在空气,一有气泡立即收集得到氧气不纯 A
D A 试管口没有塞棉花 防止水槽中的水沿导管进入试管,使试管炸裂 开始出来的气体中存在空气,一有气泡立即收集得到氧气不纯 A 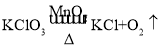 分解反应 密度比空气小,不与空气中的成分反应,易(能)溶于水等 AE
分解反应 密度比空气小,不与空气中的成分反应,易(能)溶于水等 AE
【解析】
(1)①是铁架台;②是水槽;③是试管;
(2)用过氧化氢和二氧化锰来制取氧气,反应物的状态是固体与液体,不需要加热,属于固、液常温型,适合用装置B作发生装置;过氧化氢在二氧化锰的催化作用下生成水和氧气,符号表达式为: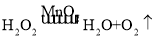 ;氧气不易溶于水,密度比空气大可用排水法或向上排空气法收集,排水法收集的氧气较纯净,可选用装置D能收集到较纯净的氧气;
;氧气不易溶于水,密度比空气大可用排水法或向上排空气法收集,排水法收集的氧气较纯净,可选用装置D能收集到较纯净的氧气;
(3)用高锰酸钾来制取氧气,反应物的状态是固体,反应需要加热,属于固、固加热型,应该用装置A作发生装置;他采用排水法收集氧气,结果发现水槽中的水变红了,可能是试管口没有塞棉花,高锰酸钾通过导管进入水槽;实验结束时为了防止水槽中的水沿导管进入试管,使试管炸裂,要先移出导管,再熄灭酒精灯;导管口开始冒气泡不能马上收集的原因是开始出来的气体中存在空气,一有气泡立即收集得到氧气不纯;
(4)用氯酸钾和二氧化锰来制取氧气,反应物的状态是固体,反应需要加热,属于固、固加热型,应该用装置A作发生装置,氯酸钾在二氧化锰催化作用下,加热条件下分解生成氯化钾和氧气,反应的符号表达式为: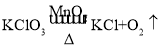 ;该反应是由一种物质生成两种物质的反应,基本反应类型为分解反应;
;该反应是由一种物质生成两种物质的反应,基本反应类型为分解反应;
(5)若收集某气体时只能选用E装置,说明该气体只能用向下排空气法收集,则可推知该气体的性质是:密度比空气小,不与空气中的成分反应,易(能)溶于水等。
(6)根据“加热氯化氨和熟石灰两种固体的混合物可制取氨气”可知,该反应物的状态是固体,反应需要加热,属于固、固加热型,应该用装置A作发生装置;根据“氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水”可知,收集氨气只能用向下排空气法收集。最好选用气体制取装置和收集装置是AE。

 名校课堂系列答案
名校课堂系列答案【题目】某化学小组同学研究铁丝在氧气中燃烧的反应,进行了如下实验。

(1)取一段打磨好的螺旋状铁丝,在下端系一根火柴,点燃火柴,待火柴快燃尽时,插入充满氧气且放有少量水的集气瓶中。观察到如下现象:铁丝剧烈燃烧,放热,_____,集气瓶底部出现黑色固体。反应的符号表达式为_____。
(2)为了确定该黑色固体的成分,同学们查阅到以下资料:
①铁粉是黑色或灰黑色粉末。四氧化三铁为黑色固体,具有磁性。
②铁和盐酸:铁+盐酸 →氯化亚铁+氢气
四氧化三铁和盐酸反应:四氧化三铁+盐酸 →氯化铁+氯化亚铁+水
③氯化铁溶液为黄色,氯化亚铁溶液为浅绿色。
小组同学根据上述资料,猜想黑色固体的成分有三种可能:a.只含有铁;b.只含有四氧化三铁;c._____。经过讨论发现,猜想_____不合理,可以排除。
(3)有同学提出:用磁铁来确定黑色固体的成分。其他同学表示反对,其理由为_____。
(4)经过讨论,同学们设计了以下实验方案,通过实验确定了黑色固体的成分。
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,加入适量盐酸,放置一段时间 | 现象1:液体由无色变为黄色 | _____。 |
现象2:_____。 | 黑色固体中含有铁 |
【题目】重庆凤中的同学们在学习了催化剂的知识后提出:氧化铁固体(Fe2O3,难溶于水)在双氧水制氧气的反应中能否起到类似二氧化锰的催化作用呢?于是进行了以下探究:
(猜想)Ⅰ、Fe2O3既不是催化剂,也不是反应物,反应前后质量和化学性质不变;
Ⅱ、Fe2O3是反应物,要生成O2,反应前后质量和化学性质要改变;
Ⅲ、Fe2O3是该反应的催化剂,反应前后_____;
(实验)用天平称量1g Fe2O3固体,取10mL10%的双氧水于试管中,进行实验:

(1)实验过程中记录现象如下:
步骤①现象 | 步骤③现象 | 步骤⑥ | 结论 |
无明显变化 | _____ | 称得固体质量为1g | 猜想Ⅲ成立. |
(2)老师指出上述实验不能证明Fe2O3是该反应的催化剂,理由是_____(填序号);
A 只有二氧化锰能起催化作用
B 未验证回收的固体是否仍是Fe2O3
C 未验证回收的固体的物理性质
D 未验证Fe2O3是否改变反应速率
(3)步骤③中,试管中各物质质量随反应时间t变化曲线正确的是_____(填序号)。
【题目】某班分组进行粗盐提纯实验,步骤见下图,请回答:
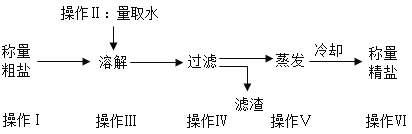
(1)实验室称量固体的仪器常用电子天平,若需直接显示所称固体的质量,在放称量纸或烧杯后,需要进行____________操作(填“校正”“归零”“去皮”)。
(2)操作ⅢI、V、V中都用到的玻璃仪器是 ____________,该仪器在操作IV中的作用是_________.
(3)粗盐提纯实验步骤较多、操作烦琐,可以缩短粗盐提纯实验时间的操作的是________
A 研碎粗盐 B 溶解时多加一倍的水
(4)操作V蒸发,为防止蒸发皿中的液滴飞溅,应采取的措施是___________;当蒸发皿中出现大量晶体时,应___________,利用________将水分蒸干。
(5)某同学过滤完后发现滤液依然浑浊,除了滤纸可能破损以外,请你再写出一种造成滤液浑浊的原因________
(6)以下混合物能用“溶解-过滤”操作进行分离的是_______
A 食盐和白糖 B 食盐和细沙 C 食盐和味精 D 豆油和水
(7)各小组的产率及评价如下:
组别 | 1 | 2 | 3 | 4 |
产率 | 75% | 83% | 88% | 72% |
教师对产率的评价 | 偏低 | 偏高 | 偏高 | 偏低 |
下列各组同学对造成产率偏高或偏低的原因分析,正确的是__________(填编号).
A.第1组:烧杯里的食盐未溶解完就开始过滤
B.第2组:蒸发时,有固体物质飞溅
C.第3组:滤液浑浊就开始蒸发
D.第4组:蒸发后,精盐中还有水分