题目内容
【题目】向硝酸亚铁、硝酸银、硝酸镁的混合溶液中加入一定量的锌粉,充分反应后过滤,得到滤液和滤渣。
(1)若向滤渣中加稀盐酸无气泡,则滤液中一定含有的金属离子为_____________(填符号)。要进一步确定可能含有的溶质,可在滤液中加入_____________溶液。
(2)若反应前后溶液的质量不变,则分别与硝酸亚铁、硝酸银反应的锌的质量比为______________。
【答案】Zn2+、Fe2+、Mg2+ 盐酸 151:9
【解析】
向硝酸亚铁、硝酸银、硝酸镁的混合溶液中加入一定量的锌粉,锌先与硝酸银反应生成硝酸锌和银,待硝酸银完全反应后,锌再与硝酸亚铁反应生成硝酸锌和铁,在金属活动性顺序里,锌位于镁之后,锌不与硝酸镁反应。
(1)若向滤渣中加稀盐酸无气泡,说明滤渣中不含氢前金属,即不含锌和铁,说明锌不足,只和硝酸银发生了反应,锌可能恰好和硝酸银完全反应,这时滤液中含有的金属离子为:Zn2+、Fe2+、Mg2+,也可能置换了部分硝酸银,这时滤液中含有的金属离子为:Zn2+、Fe2+、Mg2+、Ag+,故滤液中一定含有的金属离子为:Zn2+、Fe2+、Mg2+;
要进一步确定可能含有的溶质,由于硝酸银能与盐酸反应生成氯化银和硝酸,有白色沉淀产生,说明含有硝酸银,无白色沉淀产生,说明不含硝酸银,故可加入盐酸,故填:盐酸;
(2)反应前后溶液的质量不变,设与硝酸银反应的锌的质量为m,溶液减少的质量为x

![]() x=151m/65
x=151m/65
设与硝酸亚铁反应的锌的质量为y

![]() y=151m/9
y=151m/9
故分别与硝酸亚铁、硝酸银反应的锌的质量比为:151m/9:m=151:9。

 名校课堂系列答案
名校课堂系列答案【题目】(1)如图是实验室常用的实验装置,请回答下列问题:
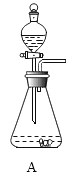
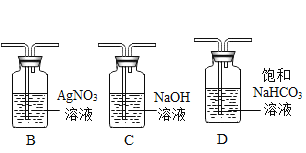
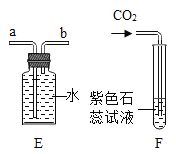
①写出用A、E装置组合制取某种气体的化学方程式______________;用E装置收集该气体,气体从____________ (填“a”或“b”)端进入。
②实验室制取的CO2中常含有少量杂质气体会干扰F实验的目的。为排除干扰,除去该杂质并检验是否除净,具体操作是:先将混合气体依次通过上述装置中的_________________(填序号),然后再进入F装置;其中除去杂质气体的化学方程式为____________________;F装置内产生的现象为____________________。
(2)皮蛋又称松花蛋,因其风味独特, 深受人们喜爱。某兴趣小组在市场上获得了少许腌制皮蛋的原料,拿到实验室进行实验,将该固体混合物放于烧杯中,加入足量的蒸馏水,搅拌,充分溶解后过滤,得到白色沉淀A和无色澄清滤液B。
[查阅资料]
腌制皮蛋的原料配方是少量NaCl、CaO和过量Na2CO3的固体混合物。
[理论推理]
①白色沉淀A是CaCO3,请写出生成该沉淀的化学方程式____________________;
②滤液B中含有Na2CO3、NaOH、NaCl三种溶质。
[实验验证]
为证明滤液B中存在的三种溶质,同学们进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
1.取少量滤液B于试管中,加入过量的Ba(NO3)2溶液,过滤 | ____ | 滤液B中含有Na2CO3、NaOH、NaCl |
2.取少量步骤1中所得滤液于试管中,加入_______ | _______ | |
3.______ | _____ |
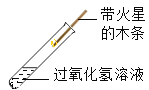
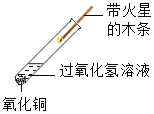
【题目】某化学兴趣小组对“氧化铜能否作过氧化氢分解的催化剂”进行了如下探究:
(实验探究)
实验编号 | 实验操作 | 实验现象 | 实验分析或结论 | |
实验分析 | 实验结论 | |||
① |
| 有少量气泡产生,木条不复燃 | 过氧化氢能分解,但是______ | 氧化铜是过氧化氢分解的催化剂 |
② |
| ________ | 氧化铜能加快过氧化氢的分解速率 | |
(1)写出实验②中发生的反应的化学方程式:___________________________________。
(交流反思)实验过程中加入两支试管中的过氧化氢溶液应满足的要求除了体积和温度相同之外,还要保证___________相同。
(2)小明同学认为仅由上述实验还不能完全得出表内的“结论”,他补充设计了以下两个探究实验。
实验一:称量反应后的固体质量,并与反应前的称量数据作比较,其目的是证明___________。
实验二:另取5 mL 5%的过氧化氢溶液于试管中,再向其中加入实验②反应后的固体剩余物,其余操作同实验②,其目的是证明___________;小明在进行实验时,发现试管内有许多水雾,由此推断过氧化氢分解是____(填“吸热”或“放热”)反应。
(实验拓展)小红同学用MnO2、CuO两种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,探究分解过氧化氢溶液制取氧气的适宜催化剂。
实验操作:取30粒含MnO2的海藻酸钠微球,采用图1装置进行实验。然后改用等量含另一种催化剂的海藻酸钠微球,重复上述实验,得到图2的锥形瓶内压强随时间变化的曲线图。
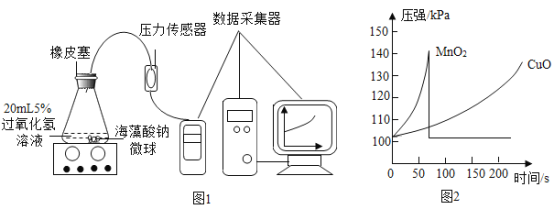
(3)每次实验时,海藻酸钠微球数应保持相同的原因是_________________________。
(4)用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是_________________________。
(5)从实验曲线看,催化效果较好、反应温和的催化剂是_________________________。