题目内容
【题目】金属在当前科技、生产中应用广泛。
(1)我国自行研发的大型客机选用铝合金做飞机机身而不选用纯铝,主要原因是铝合金硬度和强度__________(“大于“或小于”) 纯铝。
(2)开采海域“可燃冰”的钻井平台“蓝鲸一号”使用了大量的金属材料。下列措施中哪一项不能有效防止金属锈蚀?__________(填字母序号)
A.在金属表面涂油或剧漆 B.制成耐腐蚀的合金 C.打磨掉铝制品表面的氧化膜
(3)某化工厂的废液中主要含有硝酸银、硝酸铜。取一定量的该废液样品,加入铁粉,充分反应后过滤,得到滤液和滤渣。写出铁与硝酸银溶液反应的化学方程式__________。反应后得到滤液的质量__________(填“小于”、“大于”或“等于”)反应前所取废液样品的质量。
(4)某钢铁厂每天需消耗4900t 含Fe2O3 76%的赤铁矿石,该厂理论上每天生产含Fe98%的生铁的质量是_____________t。
(5)为比较铝和铁的金属活动性,某同学设计实验方案:将铝和铁分别放入盐酸中,比较反应的剧烈程度。你认为该方案__________(填“合理”或“不合理”),理由是__________。
【答案】 大于 C 2AgNO3+Fe═2Ag+Fe(NO3)2 大于 2660 不合理 没有控制铝和铁与稀盐酸的接触面积 。
【解析】(1)选用铝合金做飞机机身而不选用纯铝,主要原因是铝合金硬度和强度大于纯铝;
(2)A、在金属表面刷漆或是涂油能阻止金属与氧气、水的接触,防止金属生锈,正确;
B、将金属制成耐腐蚀的合金能防止金属生锈,正确;
C、用砂纸擦去铝制品表面的氧化膜会破坏保护层,加速锈蚀,错误。故填:C。
(3)铁的活动性大于铜和银,所以向含有硝酸铜和硝酸银的废液中加入铁粉,铁先与硝酸银反应生成银和硝酸亚铁,然后再与硝酸铜反应生成铜和硝酸亚铁;方程式为:2AgNO3+Fe═2Ag+Fe(NO3)2、Fe+Cu(NO3)2=Fe(NO3)2+Cu;由方程式可知参加反应中的铁的质量均小于被置换出的铜和银的质量,所以反应后溶液的质量增加了;
(4)设日产含Fe98%的生铁的质量为x。
Fe2O3+3CO![]() 2Fe+ 3CO2
2Fe+ 3CO2
160 112
4900t×76% x×98%
![]()
解得:x=2660t
(5)铝和铁与稀盐酸接触面积若不同,是不能进行比较,所以这种方法不能得出谁的活动性更强;

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】人教版新课标化学教材九年级上册 “分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
I.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
|
IV分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
|
(实验结论)
(1)A中产生的气体是______;
(2)实验II、III证明:氧化铁的____和____在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的文字表达式____。
(实验评价)
(1)实验设计IV的目的是____;
(2)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是____。
(实验拓展)查阅资料得知,氧化铜、硫酸铜、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是___。
A MnO2只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质不可能是其他反应的反应物或生成物。
【题目】某校化学兴趣小组就空气中氧气的含量进行实验探究,请你参与。

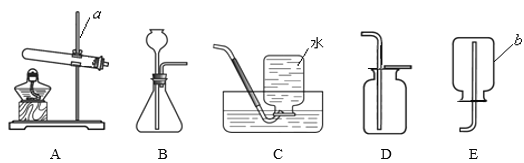
(设计实验)第一小组同学共同设计了如图的 A、B 两套装置。你认为合理的是(填编号)______________。
(进行实验)
(数据分析)实验结束后,整理数据如下:(注:集气瓶容积为 100ml)
组 别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入瓶中水的体积(ml) | 20 | 18 | 19 | 17 | 21 | 19 |
(1)第二小组同学设计了 C 实验装置,优点是:__________________________。
(2)第三小组同学设计了D 实验装置,优点是:__________________________。