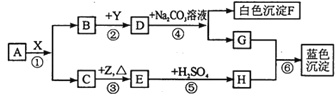
题目内容
【题目】某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。(提示: ①在溶液中,Fe 与Fe3+ 能发生反应生成Fe2+。②在溶液中,Fe2+与 H202 能发生反应生成Fe3+)。
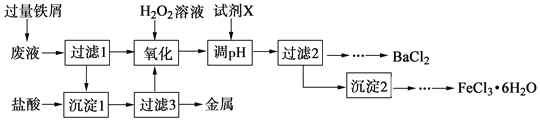
(1)沉淀1中含有的金属单质是___________。
(2)写出铁屑与废液中三氯化铁发生反应的化学方程式______________________。写出加入过氧化氢溶液后其与Fe2+反应的化学方程式______________________。
(3)下列物质中,可以作为试剂X的是___________(填字母)。
A.BaCl2 B.BaCO3 C.NaOH D.Ba(OH) 2
(4)检验沉淀2洗涤是否完全的方法是___________________________。
(5)由过滤2得到的滤液制备BaCl2的实验操作依次为________、冷却结晶、过滤、 洗涤、干燥 。
【答案】 Cu、Fe Fe+2FeCl3=3FeCl2 2FeCl2+2HCl+H2O2=2FeCl3+2H2O BD 取少量最后的洗涤液于试管中,加入Na 2SO4溶液(或硝酸银溶液),如果没有沉淀产生,证明沉淀已经洗涤干净 蒸发浓缩(或蒸发、加热、加热蒸发等)
【解析】加入的过量的铁屑,由于铁的化学性质比铜活泼,因此可以把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在过滤得到的沉淀1中含有的金属单质铜过量的铁;滤液含有二价铁离子、钡离子、氯离子,加双氧水将二价铁氧化成三价铁离子,再加碱调节PH值使三价铁离子转变成氢氧化铁沉淀而除去,所以沉淀2为氢氧化铁,进一步转化成氯化铁晶体,而滤液2则只剩氯化钡溶液,经过蒸发浓缩,冷却结晶、过滤、洗涤、干燥进一步转化成氯化钡固体;
(1)废液中含有Fe3+、Cu2+两种金属离子,加入过量的铁粉后,铜离子被还原成金属铜,所以在第①得到的沉淀中含有金属铜和过量的铁;
(2)根据以上分析,铁溶解于氯化铁生成氯化亚铁,发生反应的化学方程式为;Fe+2FeCl3=3FeCl2;氧化时加入H2O2溶液与二价铁离子发生氧化还原反应,反应的化学方程式为:2FeCl2+2HCl+H2O2=2FeCl3+2H2O;
(3)根据以上分析,加试剂X调节PH值使三价铁离子转变成氢氧化铁沉淀而不能引入新的杂质,所以选BD,故选:BD;
(4)取最后一次洗涤液少许,滴入1~2滴硫酸钠溶液,若不出现白色浑浊,表明已洗涤完全;(或取最后一次洗涤液少许,滴入1~2滴硝酸银溶液,若不出现白色浑浊,表明已洗涤完全);
(5)根据以上分析,氯化钡溶液,经过蒸发浓缩,冷却结晶、过滤、洗涤、干燥进一步转化成氯化钡固体。

【题目】甲组同学往20克10%的氢氧化钠溶液样品中滴加10% 的盐酸(室温下)。
下图描述的是氢氧化钠与盐酸反应的微观实质。

(1)从分类角度:氢氧化钠属于_________。
A、氧化物 B、酸 C、碱 D、盐
(2)从宏观与微观角度:
请从微观的角度分析,甲、乙处应填入的化学符号依次是________、______。
请用离子符号表示酸碱中和反应的本质:______________________________________。
判断在盐酸溶液中一定能大量共存的离子组是(_________________)
A、Na+、K+、CO32- B、Ag+、NO3-、SO42-
C、Cu2+、NO3-、OH- D、K+、NH4+、SO42-
(3)从能量角度,反应中溶液温度的变化 记录如表,据表数据分析:
加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
溶液温度上升(△t)/℃ | 5.6 | 12.1 | 18.5 | 15.2 | 13.5 |
①当加入盐酸体积为_____mL时,表明NaOH与HCl恰好完全反应。>此判断的依据是____________________。
②当加入4mL盐酸时,烧杯中溶液仍然呈红色,该溶液中含有的溶质有酚酞和_________________(写化学式)