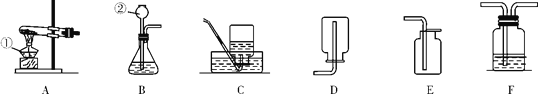
题目内容
【题目】某研究小组欲检验草酸晶体样品分解产物并测定器质量分数(假设杂质不参与反应)。草酸晶体( H2C2O42H2O)的理化性质见表。
熔点 | 沸点 | 热稳定性 | 与澄清石灰水反应 |
101°C~102°C | 150°C~160°C升华 | 100.1°C失去结晶水,175°C分解成CO2,CO,H2O | 与Ca(OH)2反应产生白色沉淀(CaC2O4) |
(1)加热分解草酸晶体最适宜的装置是____________(填图1字母序号)。
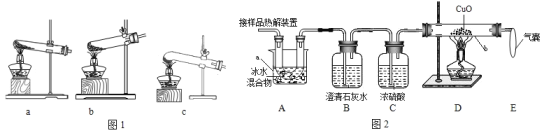
(2)图2是验证热分解产物中含CO,CO2的装置
①仪器a和b的名称分别是____________和____________。
②证明存在CO2的现象是________________________,证明存在CO的现象____________,D中反应的化学方程式是_____________。
③装置A的作用是____________________,气囊的作用是________________________。
(3)为测定样品中草酸晶体的质量分数,设计两种如下方案。
①称一定量样品用上图装置进行实验,测得装置D反应前后的质量差,由此计算出的实验结果比实际值偏低,排除仪器和操作的因素,其原因可能有:CO未完全反应、___________________________。
②称取8.75g草酸晶体样品配制50.00g溶液,取10.00g溶液加适量的稀硫酸,然后滴加25.00g3.16%KMnO4溶液,恰好反应完全。
(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)则KMnO4溶液显____________色,25.00g3.16%KMnO4溶液中KMnO4的质量____________g。样品中草酸晶体的质量分数为____________。
【Mr(H2C2O4)=90,Mr(H2C2O42H2O)=126,Mr(KMnO4)=158】。
【答案】(1)C(2)①烧杯,硬质玻璃管②B中除去石灰水变浑浊;
D中固体由黑色变成红色; ![]() ;
;
③将草酸蒸汽冷凝,以免干扰二氧化碳的检验;收集尾气;
(3)①生成的铜再次被氧化;②紫红,0.79 , 90% 。
【解析】
试题分析:(1) 加热分解草酸晶体 ,若选装置 a 可能会造成的后果是因为试管是直的固体药品熔化后会流到试管口;若选装置B可能会造成的后果是加热过程中会产生一部分水蒸气,预冷会冷凝,冷凝水会倒流到试管底,造成试管破裂,故选c装置;
(2)检验二氧化碳利用的是除去石灰水,检验一氧化碳要利用一氧化碳的还原性,并要检验还原后的产物。在检验气体是不受干扰①装置 A 的作用是除去草酸蒸气,防止对二氧化碳的检验产生干扰;反应一氧化碳生成,同时一氧化碳是空气污染物,所以气囊的作用是收集未反应的一氧化碳,防止空气污染;;② 证明存在 CO2的现象是B装置内的澄清石灰水变浑浊; 证明存在 CO 的现象是D装置中黑色固体变红;
(3)①为测定样品中草酸晶体的质量分数,设计如下方案:称取一定量样品,用上述装置进行实验,称量装置D反应前后的质量差。由此计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因:一氧化碳没有全部与氧化铜反应、草酸中的碳元素没有完全转化为一氧化碳等;
②高锰酸钾溶液呈紫红色;25.00g3.16%KMnO4溶液中KMnO4的质量=25.00g×3.16%=0.79g;
设10.00g溶液中含草酸晶体的质量为X,
由2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
可知,5H2C2O42H2O→5H2C2O4→2KMnO4,
630 316
X 0.79g
630/316=X/0.79g
X=1.575g,
50.00g溶液中含草酸晶体的质量为:1.575g×5=7.875g,
草酸晶体的质量分数为:7.875g/8.75g×100%=90%,
答:样品中草酸晶体的质量分数为90%.