题目内容
【题目】(3分)空气中的各组分在生活中应用广泛。
(1)食品包装中常填充N2以防腐,是由于N2的化学性质 (填“活泼”或“不活泼”)。
(2)向鱼缸内加入少量双氧水,会缓慢产生O2,从而增加鱼缸内的溶氧量。发生反应的化学方程式为 。
(3)制备碳酸饮料时需用到CO2,将CO2通入水中发生反应的化学方程式为 。
【答案】(1)不活泼 (2)2H2O2 2H2O+O2↑ (3)CO2 + H2O H2CO3
【解析】
试题分析:食品包装中常填充N2以防腐,是由于N2的化学性质不活泼;双氧水会分解产生氧气和水;CO2通入水中发生反应生成碳酸。

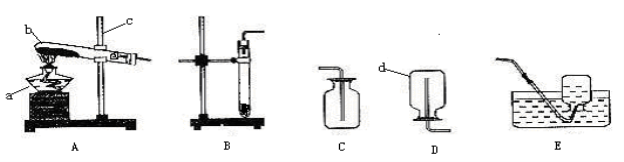
【题目】某研究小组欲检验草酸晶体样品分解产物并测定器质量分数(假设杂质不参与反应)。草酸晶体( H2C2O42H2O)的理化性质见表。
熔点 | 沸点 | 热稳定性 | 与澄清石灰水反应 |
101°C~102°C | 150°C~160°C升华 | 100.1°C失去结晶水,175°C分解成CO2,CO,H2O | 与Ca(OH)2反应产生白色沉淀(CaC2O4) |
(1)加热分解草酸晶体最适宜的装置是____________(填图1字母序号)。

(2)图2是验证热分解产物中含CO,CO2的装置
①仪器a和b的名称分别是____________和____________。
②证明存在CO2的现象是________________________,证明存在CO的现象____________,D中反应的化学方程式是_____________。
③装置A的作用是____________________,气囊的作用是________________________。
(3)为测定样品中草酸晶体的质量分数,设计两种如下方案。
①称一定量样品用上图装置进行实验,测得装置D反应前后的质量差,由此计算出的实验结果比实际值偏低,排除仪器和操作的因素,其原因可能有:CO未完全反应、___________________________。
②称取8.75g草酸晶体样品配制50.00g溶液,取10.00g溶液加适量的稀硫酸,然后滴加25.00g3.16%KMnO4溶液,恰好反应完全。
(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)则KMnO4溶液显____________色,25.00g3.16%KMnO4溶液中KMnO4的质量____________g。样品中草酸晶体的质量分数为____________。
【Mr(H2C2O4)=90,Mr(H2C2O42H2O)=126,Mr(KMnO4)=158】。