题目内容
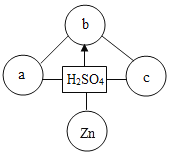
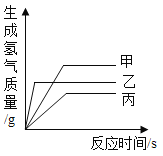
【题目】下列图像中,能正确反映对应变化关系的是
|
|
|
|
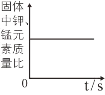
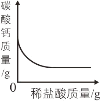
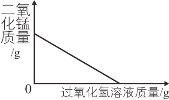
A.加热一定质量的高锰酸钾制氧气 | B.将水通电电解一段时间 | C.向一定量CaCO3中加入稀盐酸 | D.向一定量的二氧化锰中加入过氧化氢溶液 |
A.AB.BC.CD.D
【答案】A
【解析】
A、加热一定质量的高锰酸钾制氧气,还生成了锰酸钾和二氧化锰,钾元素和锰元素一直存在于固体中,钾元素的质量不变,锰元素的质量不变,则钾元素和锰元素的质量比也不变,故A正确;
B、电解水实验中,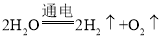 ,生成的氢气和氧气的体积比是2:1,质量比是(2×2):32=1:8,故B错误;
,生成的氢气和氧气的体积比是2:1,质量比是(2×2):32=1:8,故B错误;
C、向一定量CaCO3中加入稀盐酸,碳酸钙和盐酸反应生成氯化钙、水、二氧化碳,碳酸钙的质量逐渐减小,完全反应后为0,故D错误。
D、向一定量的二氧化锰中加入过氧化氢溶液,二氧化锰是该反应的催化剂,质量不变,故D错误。
故选:A。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?
(1)小林准备用如图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气,记录2分钟收集的气体体积。请写出过氧化氢分解的反应方程式:_____________。
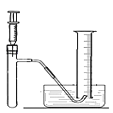
(2)小林查阅了相关资料,并进行了探究实验
(查阅资料)
①过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
②温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5mL | 。 |
② | 分两次进行实验 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5mL过氧化氢溶液 第二次 | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为 | 过氧化氢分解加快是因为过氧化氢酶的作用 |
a.实验①结论是_____________ 。
b.实验②中横线部分应进行的操作是____________。
c.实验②中第二次收集到的氧气体积为__________。
(实验反思)
小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
d.通过这些数据,你能得出的新结论是______________。
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/mL | 39 | 56 | 34 | 5 | 5 | 5 |