题目内容
【题目】研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
(假设)过氧化氢生成氧气的快慢与催化剂种类有关
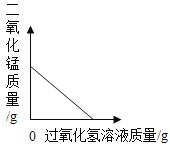
(实验方案)常温下,在两瓶体积相同、浓度相同的过氧化氢溶液中分别加入相同质量的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间。
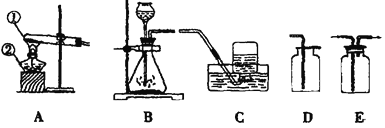
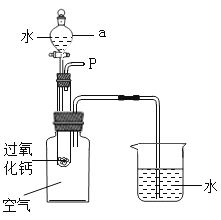
(进行实验)图示是他们进行实验的装置图,气体发生装置中A仪器的名称是:_________,此实验中B处宜采用的气体收集方法是_____________。

(实验记录)
实验编号 | 1 | 2 |
反应物 | 6% 过氧化氢 | 6% 过氧化氢 |
催化剂 | 1 g红砖粉 | 1 g 二氧化锰 |
时间 | 152 s | 35 s |
(结论)该探究过程得出的结论_____________________。
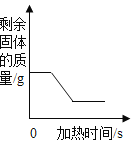
(反思)过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快。若要证明二氧化锰和红砖粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的___________和_________是否变。
过氧化氢生成氧气的快慢还与哪些因素有关?请你帮助他们继续探究。____________ (只要求提出假设和实验方案)
【答案】锥形瓶 排水集气法 在相同条件下,过氧化氢生成氧气的快慢与催化剂的种类有关 质量 化学性质 [假设]过氧化氢生成氧气的快慢与过氧化氢溶液的浓度有关。
[实验方案]常温下取两份体积相等的5%和10%的过氧化氢溶液,分别加入相同质量的同种催化剂,测量各收集一瓶气体所需的时间
【解析】
进行实验::
据图可知仪器的名称是锥形瓶。氧气不易溶于水,且密度比空气大,因此可以采用排水法或向上排空气法收集,因为需要观察收集一瓶气体所用的时间,宜用排水法;
实验结论:
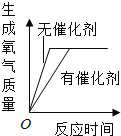
根据控制变量法,分析表中的有关数据,可知分别用1g红砖粉和1gMnO2做催化剂,来催化反应时所用的时间分别是165s和46s;由此可知,用1gMnO2做催化剂要比用1g红砖粉做催化剂时,化学反应速率要快。因此,由实验现象可以得出的实验结论是:H2O2生成氧气的快慢与催化剂种类有关;
反思:
根据催化剂的概念可知,催化剂能改变化学反应的速率,而本身的质量和化学性质在反应前后不改变;
假设:
可以假设:H2O2生成氧气的快慢与过氧化氢的浓度有关;
实验方案:
在温度、相同质量的相同催化剂的条件下,采用等质量但不同的浓度的过氧化氢溶液来进行实验,然后测量收集相同体积的气体所需的时间,从而得出结论。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案【题目】化学课上,同学们做了人体呼出的气体使澄清石灰水变浑浊的实验后,对呼出的气体种主要成分及含量非常好奇,设计实验进行探究。
(提出问题)呼出气体中有哪些主要成分,它们的含量是多少?
(查阅资料)(1)呼出气体中仍含有O2;
(2)白磷和红磷具有相似的化学性质。
(猜想与实验)猜想:呼出的气体中主要成分是N2、O2、CO2、水蒸气等。
实验Ⅰ:验证呼出的气体中含有水蒸气。
(1)实验操作如图所示。

(2)观察到的实验现象为_____。根据该现象可以判断呼出的气体中含有水蒸气。
实验Ⅱ:验证呼出的气体中主要成分是N2、O2、CO2,并测定其含量。同学们在老师的指导下设计了如下图所示装置。
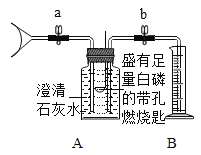
(1)实验记录
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性,向装置中加入药品 | 装置气密性良好 | |
② | 打开止水夹a、b,吹入500mL呼出气体。关闭a、b,并冷却到室温。 | _____,量筒内进入475mL液体 | 呼出的气体中CO2的体积为_____mL |
③ | 用凸透镜聚光引燃白磷。 | _____ | 反应的文字表达式为_____。 |
④ | 待白磷熄灭并冷却到室温,打开b | B中部分液体倒吸入A中;B中剩余液体为400mL | 呼出的气体中含有N2和O2的体积分别_____mL和为_____mL |
(实验反思)
(1)该实验设计依据的N2性质有_____(填字母序号)
A 难溶于水 B 无色无味 C 不和澄清石灰水反应 D 不能燃烧,也不支持燃烧
(2)实验Ⅱ操作④中,若A中气体未完全冷却就打开b并读数,则所测O2的体积分数_____(填“偏小”、“不变”或“偏大”)