题目内容
下列除去杂质的方法正确的是
- A.除去CO2中的少量HCl:通入NaOH溶液,收集气体
- B.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
- C.除去NaCl溶液中的CuSO4:加入适量Ba(OH)2溶液,充分反应后过滤
- D.除去FeCl2溶液中的少量CuCl2:加入足量镁粉,充分反应后过滤
分析:根据物质的性质和除杂质的原则,所选的除杂剂不能与原物质反应,不能带入新的杂质,除杂剂与杂质反应后,能把杂质吸收或转化为便于和原物质分离的成分.
解答:A、除去CO2中的少量HCl:通入NaOH溶液后,二氧化碳也会被吸收,把原物质也除掉了,方法错误.
B、除去KCl溶液中的少量MgCl2,加入适量NaOH溶液,反应后会带入氯化钠杂质,故方法错误;
C、除去NaCl溶液中的CuSO4:加入适量Ba(OH)2溶液,充分反应后过滤,不会带入新的杂质,故方法正确.
D、除去FeCl2溶液中的少量CuCl2:加入足量镁粉,把氯化铜中的铜置换出来,也把氯化亚铁中的铁置换出来,方法错误.
故选C
点评:进行物质除杂时,要根据物质的性质进行,可以采用物理或化学方法,要求选用的除杂试剂反应后不能产生新的杂质且不能与原有物质反应.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案(本题共12分)
已知:
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 正丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
 根据题意完成下列填空:
根据题意完成下列填空:
(一)制备1-溴丁烷粗产品
在右图装置的圆底烧瓶中依次加入NaBr,10 mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30 min。
(1)写出制备1-溴丁烷的化学反应方程式:
__________________________________________________
(2)反应装置中加入沸石的目的是__________________。
配制体积比为1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(3)反应装置中,除了产物和水之外,还可能存在 、 等有机副产物。
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
 (二)制备精品
(二)制备精品
将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按右图装置蒸馏。
(5)收集产品时,控制的温度应在_________℃左右;
区分1-溴丁烷精品和粗品的一种方法是____________________。
(6)实验制得的1-溴丁烷的质量为10.895 g,则正丁醇的转化率为 。(保留3位小数)。

 (2012?潍坊二模)化学实验课上老师要求分组除去铁制品和锈铜币表面的锈层并对废液进行处理.请你参与并回答相关问题.
(2012?潍坊二模)化学实验课上老师要求分组除去铁制品和锈铜币表面的锈层并对废液进行处理.请你参与并回答相关问题.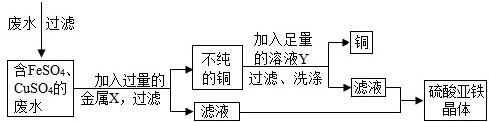
 如图是小红同学用来电解水的简易装置图.请你参与探究并回答下列问题:
如图是小红同学用来电解水的简易装置图.请你参与探究并回答下列问题: