题目内容
 (2012?潍坊二模)化学实验课上老师要求分组除去铁制品和锈铜币表面的锈层并对废液进行处理.请你参与并回答相关问题.
(2012?潍坊二模)化学实验课上老师要求分组除去铁制品和锈铜币表面的锈层并对废液进行处理.请你参与并回答相关问题.实验一:表面除锈:
甲组:将锈铁器放入适量稀硫酸中,微热.观察到①溶液变成黄色,铁锈逐渐消失.一段时间后,②锈层完全消失,铁器表面有细小气泡产生,③黄色溶液逐渐变为浅绿色.
现象①发生的化学反应方程式为:
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
,②中铁器表面的气泡是氢气
氢气
;大家对现象③不理解,老师补充说明了,金属铁具有还原性,能将正三价的铁离子还原成亚铁离子.乙组:在锈铜钱中加入适量稀硫酸.观察到①绿色锈层很快消失,同时产生大量气泡,溶液变成蓝色.②将气体收集,通入澄清石灰水,石灰水变浑浊.由此,小军等同学推断,绿色锈层中肯定含有的元素有
铜元素、碳元素和氧元素
铜元素、碳元素和氧元素
.实验二:废液回收
废液桶中收集了溶有大量FeSO4、CuSO4的废水,若直接排放到下水道,不仅造成重金属污染而且浪费资源.小组讨论后设计了如下除去铜离子,回收硫酸亚铁晶体和铜的实验方案:
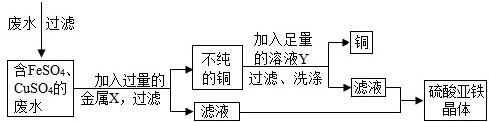
请完成下列有关问题:
(1)废水在加入金属X前需进行过滤,目的是将其中
不溶
不溶
性杂质除去.(2)金属X是
Fe(或铁)
Fe(或铁)
,其加入废水后发生反应的化学方程式为Fe+CuSO4═FeSO4+Cu
Fe+CuSO4═FeSO4+Cu
;溶液Y是稀硫酸
稀硫酸
,利用其除去铜中杂质,有关反应的化学方程式为Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
.(3)从滤液中获取硫酸亚铁晶体的操作方法是
结晶(或蒸发结晶或冷却结晶)
结晶(或蒸发结晶或冷却结晶)
.分析:实验一:铁锈的主要成分为氧化铁,可以和酸反应,同时金属铁也可以和酸反应,可以据此解答;而根据实验现象结合质量守恒定律可以完成对铜锈成分的推断;
实验二:(1)根据过滤操作的作用来解答;
(2)结合题给条件及图框信息可知:加入金属X得到了铜,可以判断金属X为铁,加入溶液Y后得到了铜,可以判断加入的Y为稀硫酸;
(3)从溶液中获取晶体一般都是通过结晶的方法来获取,可以据此解答.
实验二:(1)根据过滤操作的作用来解答;
(2)结合题给条件及图框信息可知:加入金属X得到了铜,可以判断金属X为铁,加入溶液Y后得到了铜,可以判断加入的Y为稀硫酸;
(3)从溶液中获取晶体一般都是通过结晶的方法来获取,可以据此解答.
解答:解:实验一:根据实验现象可以知道:溶液变成黄色,铁锈逐渐消失可以判断发生的反应为氧化铁和稀硫酸的反应,它们反应的化学方程式分别为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;一段时间后锈层完全消失,铁器表面有细小气泡产生,说明此时过量的硫酸和铁发生反应生成了氢气;而将铜锈加入稀盐酸中产生了使澄清石灰水变浑浊的气体,可以判断该气体为二氧化碳,所以根据质量守恒定律可以判断铜锈中含有的元素为:Cu、C、O三种元素;
实验二:(1)过滤操通常是用来分离不溶性固体和液体的一种方法;
(2)从图框中可以知道,向废液中加入过量的金属X得到了不纯的铜,根据题干要求及废水中的成分并结合最后得到对物质为硫酸亚铁晶体,可以判断金属X为铁,加入溶液Y后得到了铜,可以判断加入的Y为稀硫酸;
(3)从溶液中获取晶体一般都是通过结晶的方法来获取.
故答案为:
实验一:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O; 氢气;铜元素、碳元素和氧元素;
实验二:(1)不溶;
(2)Fe(或铁);Fe+CuSO4═FeSO4+Cu;稀硫酸;Fe+H2SO4═FeSO4+H2↑;
(3)结晶(或蒸发结晶或冷却结晶).
实验二:(1)过滤操通常是用来分离不溶性固体和液体的一种方法;
(2)从图框中可以知道,向废液中加入过量的金属X得到了不纯的铜,根据题干要求及废水中的成分并结合最后得到对物质为硫酸亚铁晶体,可以判断金属X为铁,加入溶液Y后得到了铜,可以判断加入的Y为稀硫酸;
(3)从溶液中获取晶体一般都是通过结晶的方法来获取.
故答案为:
实验一:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O; 氢气;铜元素、碳元素和氧元素;
实验二:(1)不溶;
(2)Fe(或铁);Fe+CuSO4═FeSO4+Cu;稀硫酸;Fe+H2SO4═FeSO4+H2↑;
(3)结晶(或蒸发结晶或冷却结晶).
点评:想解答好这类题目,首先,要理解和熟记酸的化学性质、用途、反应现象和化学方程式,以及与之相关的知识.然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
相关题目