题目内容
随着科技的进步,食品防腐技术在不断发展.(1)最为传统的食品防腐技术是用食盐腌制,以抑制细菌的滋生.食盐主要成分的化学式为 .
(2)在包装食品中放置抗氧化剂也是常用的方法,铁粉是常用的抗氧化剂,俗称“双吸剂”,原因是 .
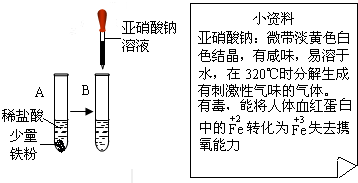
(3)在速食食品中添加防腐剂是常用的技术之一.亚硝酸钠(NaNO2)是一种常用的防腐剂.结合如图资料回答问题:
①食品添加亚硝酸钠的量要严加控制,我国规定肉灌肠中亚硝酸钠的最高添加标准为每千克食品含量不超过150毫克,以此计算,200g15%的亚硝酸钠溶液至少可用于生产肉灌肠 千克.
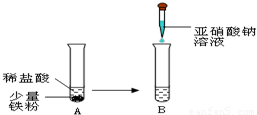
②针对资料,小明设计如图实验:
实验A中观察到的现象是 ,反应的化学方程式为 .实验B观察到溶液由浅绿色变为黄色,小明设计上述实验的目的是 .
③亚硝酸钠加热分解放出有刺激性气味的气体,该气体不可能是 (填字母).A.NO2 B.NH3 C.N2D.SO2.

【答案】分析:(1)根据实验的主要成分考虑;(2)根据铁生锈的条件考虑;(3)①先计算出亚硝酸钠质量再除以每千克食品亚硝酸钠含量标准;②根据铁与酸反应的现象和方程式的写法考虑;根据铁离子与亚铁离子溶液的颜色考虑;③根据质量守恒定律考虑.
解答:解:(1)食盐主要成分是氯化钠,钠显+1价,氯显-1价,所以化学式为:NaCl;
(2)铁生锈的条件是与水喝氧气共同作用,所以既吸水又吸氧气;
(3)①200g×15%=30g即30000毫克,根据: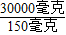 =200,所以至少可用于生产肉灌肠200千克;
=200,所以至少可用于生产肉灌肠200千克;
②铁与酸反应生成氢气和氯化亚铁,所以有气泡,亚铁离子溶液是浅绿色;反应物是铁和盐酸,生成物是氯化亚铁和氢气,用观察法配平即可,氢气后面标上上升符号;溶液由浅绿色变为黄色说明由亚铁离子变为铁离子即探究亚硝酸钠能否将 转化为
转化为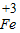
③根据质量守恒定律可知反应前后元素种类不变,亚硝酸钠中含有钠、氮、氧三种元素,而B.NH3 中出现了氢所以不对,D.SO2中出现了硫,所以不对,又因为氮气是无色无味所以C也不正确.
故答案为:(1)NaCl
(2)铁粉能吸收氧气和水分
(3)①200
②铁粉逐渐消失,有气泡冒出,溶液变为浅绿色;Fe+2HCl═FeCl2+H2↑;探究亚硝酸钠能否将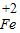 转化为
转化为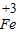
③BCD
点评:通过回答本题知道了铁做双吸剂的原因,知道了铁与盐酸反应的实验现象,方程式的写法.
解答:解:(1)食盐主要成分是氯化钠,钠显+1价,氯显-1价,所以化学式为:NaCl;
(2)铁生锈的条件是与水喝氧气共同作用,所以既吸水又吸氧气;
(3)①200g×15%=30g即30000毫克,根据:
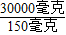 =200,所以至少可用于生产肉灌肠200千克;
=200,所以至少可用于生产肉灌肠200千克;②铁与酸反应生成氢气和氯化亚铁,所以有气泡,亚铁离子溶液是浅绿色;反应物是铁和盐酸,生成物是氯化亚铁和氢气,用观察法配平即可,氢气后面标上上升符号;溶液由浅绿色变为黄色说明由亚铁离子变为铁离子即探究亚硝酸钠能否将
 转化为
转化为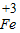
③根据质量守恒定律可知反应前后元素种类不变,亚硝酸钠中含有钠、氮、氧三种元素,而B.NH3 中出现了氢所以不对,D.SO2中出现了硫,所以不对,又因为氮气是无色无味所以C也不正确.
故答案为:(1)NaCl
(2)铁粉能吸收氧气和水分
(3)①200
②铁粉逐渐消失,有气泡冒出,溶液变为浅绿色;Fe+2HCl═FeCl2+H2↑;探究亚硝酸钠能否将
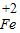 转化为
转化为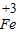
③BCD
点评:通过回答本题知道了铁做双吸剂的原因,知道了铁与盐酸反应的实验现象,方程式的写法.

练习册系列答案
相关题目

 (2010?顺义区一模)随着科技的进步,食品防腐技术在不断发展.
(2010?顺义区一模)随着科技的进步,食品防腐技术在不断发展.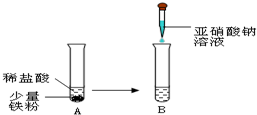 实验A中观察到的现象是
实验A中观察到的现象是