题目内容
【题目】为测定某氯化钠和硫酸镁(杂质不参加反应也不溶于水)样品中氯化钠的纯度并提纯氯化钠,探究小组进行了如下实验:
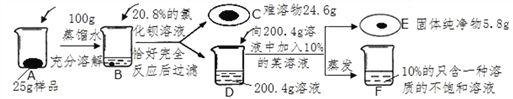
(1)B中发生反应的化学方程式为_________________________________;
(2)求解与D中溶液发生反应的某溶液的溶质质量(x)的比例式为______________;
(3)样品中氯化钠的纯度为___________;
(4)向质量分数为M 的氯化钡溶液中加入16.8mL蒸馏水可配制成上述实验中使用的氯化钡溶液,则M为______________;
(5)D→F过滤后,需蒸发水的体积为__________mL;
(6)50t上述氯化钠样品经上述提纯后,可制得纯碱的质量为________。
【答案】 BaCl2+MgSO4=BaSO4↓+ MgCl2; ![]() ; 46.8%; 25% 40.6; 42.4t
; 46.8%; 25% 40.6; 42.4t
【解析】(1)根据氯化钡溶液与硫酸镁反应生成硫酸钡沉淀和氯化镁解答;(2)根据D中溶质主要是氯化钠及氯化镁,除去杂质氯化镁必须用到氢氧化钠得到5.8g氢氧化镁沉淀计算解答;(3)根据反应的化学方程式计算解答;(4) (5) (6)根据计算解答。(1) 氯化钡溶液与硫酸镁反应生成硫酸钡沉淀和氯化镁,故B中发生反应的化学方程式为BaCl2+MgSO4=BaSO4↓+ MgCl2;(2)设与D中溶液发生反应的某溶液的溶质质量为x,参加反应的氯化镁的质量为y,生成氯化钠的质量为z。
2NaOH+ MgCl2=Mg(OH)2↓+2NaCl
80 95 58 117
x y 5.8g z
![]()
x=8g
y=9.5g
z=11.7g
(3)设与20.8%的氯化钡溶液恰好完全反应需要硫酸镁的质量为m,生成沉淀的质量为n。
BaCl2+MgSO4=BaSO4↓+ MgCl2
120 233 95
m n 9.5g
![]()
m=12g
n=23.3g
杂质的质量为24.6g-23.3g=1.3g
样品中氯化钠的纯度为![]() ×100%=46.8%
×100%=46.8%
(4)由质量守恒定律可知,加入氯化钡溶液的质量为200.4g+24.6g-100g-25g=100g。16.8mL蒸馏水约为16.8g,故原氯化钡溶液的质量为100g-16.8g=83.2g。100g×20.8%=83.2g×M,M=25%;(5)F中氯化钠的质量为11.7g+25g-12g-1.3g=23.4g。故F中溶液的质量为23.4g÷10%=234g。反应后D中溶液的质量为200.4g+8g÷10%-5.8g=274.6g,故D→F过滤后,需蒸发水的质量为274.6g-234g=40.6g,约为40.6mL;(6)50t上述氯化钠样品经上述提纯后可得氯化钠的质量为50t×![]() ×100%=46.8t,46.8t氯化钠中钠元素的质量为46.8t×
×100%=46.8t,46.8t氯化钠中钠元素的质量为46.8t×![]() ×100%=18.4t,可制得纯碱的质量为18.4t÷(
×100%=18.4t,可制得纯碱的质量为18.4t÷(![]() ×100%)=42.4t。
×100%)=42.4t。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
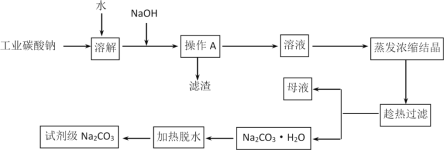
小学生10分钟应用题系列答案【题目】碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺流程如下:
碳酸钠的饱和溶液在不同温度下析出的溶质如下表所示:
温度(℃) | ﹤32 | 32~36 | ﹥36 |
析出物的化学式 | Na2CO3·10H2O | Na2CO3·7H2O | Na2CO3·H2O |
回答下列问题:
(1)操作A为过滤,所需的玻璃仪器有烧杯、玻璃棒和_____________,滤渣的主要成分为Fe(OH)3、Mg(OH)2和___________。
(2)“趁热过滤”的原因是____________________。
(3)“母液”中除了含有 Na+、CO32-、Cl-、OH-离子外,还含有________等离子(写出一个即可)。
(4)写出Na2CO3·H2O转化为Na2CO3的化学方程式_______________________________________。
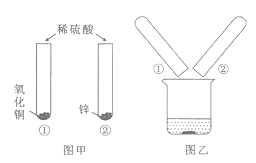
【题目】一些骗子常用黄铜冒充黄金骗取钱财,某同学通过查阅资料得知黄铜是锌和铜的合金,他取一定量的某黄铜样品放入烧杯中,再向其中分4次加入等质量的同一稀硫酸,每次均充分反应。实验过程中有关物质的用量及质量测定记录如下表:
实验次数 | 1 | 2 | 3 | 4 |
稀硫酸的用量/g | 20 | 20 | 20 | 20 |
剩余固体的质量 | 10 | 8.7 | 7.4 | 7.2 |
分析表中数据,完成下列问题:
(1)所取黄铜样品的质量为___________ g;
(2)第4次实验结束后溶液的pH __________7(填“>”、“=”或“<”);
(3)所用稀硫酸中溶质的质量分数为________________?(要求有解答过程)