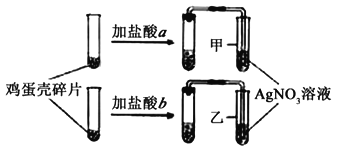
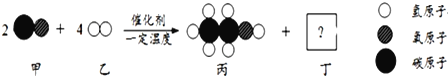
题目内容
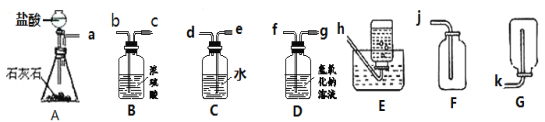
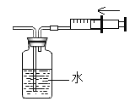
【题目】目前工业上氢气的大规模生产多采用甲烷的重整,即甲烷与水蒸气经高温催化反应生成氢气和一氧化碳。某化学兴趣小组为检验反应后的混合气体(以下简称合成气")中是否含有氢气和一氧化碳、同时检验“合成气”中是否含有未反应完的甲烷和水蒸气,进行了如下图所示的实验。(假设每步均反应完全)
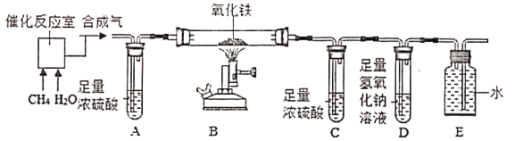
(査阅资料知,氧化铁与氢气在高温条件下反应生成铁和水;氧化铁与甲烷在高温条件下反应生成铁、二氧化碳和水)
(1)请写出一氧化碳与氧化铁在高温条件下反应的化学方程式_____;
(2)实验开始前要先通一会“合成气”,然后再点燃B处的酒精喷灯,目的是_____;
(3)装置E的作用是_____;
(4)装置C和D的连接顺序颠倒,会影响实验操作,原因是_____。
(5)实验结束后,测得装置ACD的质量均増加,其中装置C増加了2.7g,装置D増加了2.2g.则可推断出该“合成气”的组成物质为_____(写化学式)
【答案】3CO+Fe2O3![]() 2Fe+3CO2 排出装置内空气,防止H2,CO不纯而爆炸 进行尾气处理,防止污染 无法确定生成水蒸气的质量 H2O;CO;H2
2Fe+3CO2 排出装置内空气,防止H2,CO不纯而爆炸 进行尾气处理,防止污染 无法确定生成水蒸气的质量 H2O;CO;H2
【解析】
流程甲烷和水加入到催化反应室里,甲烷与水蒸气经高温催化反应生成氢气和一氧化碳,探究是否有一氧化碳和氢气,先将合成气通过浓硫酸干燥,再通入到高温的氧化铁中,氢气和一氧化碳都具有还原性,都会和氧化铁反应生成铜单质,氢气会生成水,一氧化碳生成二氧化碳,先用浓硫酸来吸收水,再用氢氧化钠吸收二氧化碳,最后将剩余气体收集。
(1)一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
(2)因为可燃性气体和氧气在密闭的条件下点燃会发生爆炸,实验开始前要先通一会“合成气”,然后再点燃B处的酒精喷灯,目的是:排出装置内空气,防止H2,CO不纯而爆炸;故填:排出装置内空气,防止H2,CO不纯而爆炸
(3)实验完毕后把尾气收集了,故装置E的作用是:进行尾气处理,防止污染。
(4)装置C是吸收水,然后称重看是否有水生成,D装置是吸收二氧化碳,若装置称重时变重了,可以证明有二氧化碳生成,若C和D的连接顺序颠倒,会影响实验操作,原因是气体先通入溶液里面,气体从溶液里出来肯定会带有水分,无法确定原来是否生成有水,更无法确定生成水蒸气的质量。
(5)实验结束后,测得装置ACD的质量均増加,A装置吸收了水分,故合成气中有水,根据定量计算:CH4+H2O![]() CO+3H2 可知若合成气中碳和氢元素的质量比为2:1时,则证明无甲烷气体,若不为2:1则有甲烷气体;其中装置C増加了2.7g水,其中氢元素质量为:
CO+3H2 可知若合成气中碳和氢元素的质量比为2:1时,则证明无甲烷气体,若不为2:1则有甲烷气体;其中装置C増加了2.7g水,其中氢元素质量为:
![]() ;装置D増加了2.2g,其中碳元素的质量为:
;装置D増加了2.2g,其中碳元素的质量为:![]() 。符合碳:氢=2:1,可推断出该“合成气”的组成物质为:H2O;CO;H2;故填:H2O;CO;H2
。符合碳:氢=2:1,可推断出该“合成气”的组成物质为:H2O;CO;H2;故填:H2O;CO;H2

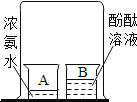
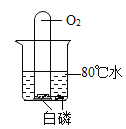
【题目】同学们发现有一种“氮气灭火装置”能利用液氮(沸点为-196℃)产生的大量氮气来灭火。他们用氮气进行如右图所示实验,却发现蜡烛未熄灭。

(查阅资料)氮气密度略小于空气;压强不变时,气体温度越低,密度越大。
(1)结合氮气性质分析,右图蜡烛未熄灭的原因可能是_______。
实验1:探究氮气能否用来灭火(所用容器均为隔热材料,下同)
实验编号 | 1-1 | 1-2 | 1-3 |
实验内容 |
|
|
|
实验现象 | 蜡烛持续燃烧 | 蜡烛缓慢熄灭 | 蜡烛熄灭 |
(2)实验前有同学提出,由液氮汽化产生的氮气温度低,密度足够大,会向下流动隔 绝可燃物周围的氧气。依据实验1判断,这种假设_____(填“成立”或“不成立”)。
(3)有同学根据实验1提出新假设,氮气灭火可能与可燃物周围氮气的含量有关。可 能支持这一假设的实验现象是_______(填实验1中的实验编号)。
实验2:探究灭火与氮气含量是否有关
实验编号 | 2-1 | 2-2 | 2-3 |
实验内容 |
|
|
|
实验现象 | 蜡烛没有熄灭 | 蜡烛缓慢熄灭 |
(4)实验2中,蜡烛所在位置氮气含量最高的是_________(填实验编号)。
(5)推测实验2-3的现象是________。
(6)反思实验2,除氮气含量外,影响蜡烛燃烧的其它可能因素是________。
(7)结合上述实验,下列关于 “氮气灭火装置”使用的说法中,合理的是______(填字母序号)。
A. 从高处向低处喷洒使用
B. 可燃物火焰熄灭后,还需持续通气一段时间
C. 在有少量排气口的封闭空间中使用时,效果好于开放空间
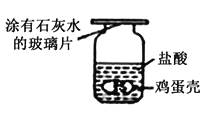
【题目】小峰同学在体育课上腿部擦伤,医务室的大夫在他伤口上涂了医用过氧化氢溶液,小峰看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?
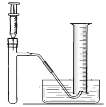
I.小峰准备用如图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。
(1)请写出过氧化氢分解的化学方程式________。
(2)若要检验生成的气体是否为氧气,可将导气管从水中取出,取带火星的木条放在导气管口处,观察到________,说明生成的气体是氧气。
II.小峰查阅了相关资料,并进行了探究实验
(查阅资料)
①过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
②温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5ml | |
② | 分两次进行实验 第一次 第二次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5ml过氧化氢溶液 | 第一次,量筒中2分钟收集到的气体体积为5ml 第二次,量筒中2分钟收集到的气体体积为 ml | 过氧化氢分解加快是因为过氧化氢酶的作用 |
(3)实验①得出的结论是_____________。
(4)实验②中“第一次”应进行的操作是_________。
(5)实验②中第二次收集到的氧气体积为________ml。
(实验反思)
小峰反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/mL | 39 | 56 | 34 | 5 | 5 | 5 |
(6)通过这些数据,你能得出的新结论是_______