题目内容
【题目】(1)(5分)家庭生活中制作食品经常用到碳酸钠(苏打)和碳酸氢钠(小苏打),碳酸氢钠不稳定,在潮湿空气中缓慢分解,受热至65 ℃ 以上迅速分解,270 ℃ 时完全分解为碳酸钠。某同学为探究它们的性质差异,设计了图所示装置并进行实验。请回答:
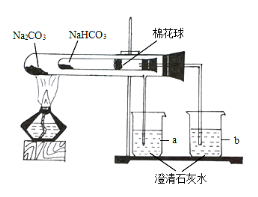
①加热一段时间后,a、b两烧杯分别看到的现象是 _______________________________________;由此可得出的结论是 ______________________;
②碳酸氢钠分解的化学反应方程式:_______________________________________;
③该装置设计的优点是 ____________________;
④实验中应注意的问题是 ________________________________________________。
(2)(6分)在日常生活和工农业生产中,溶液有着广泛的应用。比如,氨碱工业用到的是饱和食盐水,医疗上使用的则是0.9%的生理盐水。请按要求设计并完成一下实验:
实验用品:氯化钠溶液、氯化钠、硝酸钾、蒸馏水、烧杯、试管、玻璃棒、药匙
探究实验一:澄清透明的氯化钠溶液是否是饱和溶液
实验步骤 | 实验现象 | 实验结论 |
取一只试管倒入约5 mL氯化钠溶液 ,用药匙加入少量氯化钠固体,振荡,观察现象 | 氯化钠固体溶解 | ______________ ______________ |
探究实验二:将不饱和氯化钠溶液变为饱和溶液并探究饱和氯化钠溶液还能否溶解硝酸钾
实验步骤 | 实验现象 | 实验结论 |
______________________________ ______________________________ ______________________________ | _____________ _______________ _______________ | NaCl不饱和溶液 变为饱和溶液 |
______________________________ ______________________________ ______________________________ | _______________ _______________ ______________ | ________________ ________________ ________________ |
【答案】(1)(5分)
① a中石灰水不变浑浊,b中石灰水变浑浊;小苏打易分解,苏打不易分解
![]() ②
② ![]()
③对比这两种物质是否能够分解
④装置的气密性要良好、温度不能太高等(合理即可)
(2)(6分)
探究实验一:澄清透明的氯化钠溶液是否是饱和溶液
实验步骤 | 实验现象 | 实验结论 |
取一只试管倒入约5 mL氯化钠溶液 ,用 药匙加入少量氯化钠固体,振荡,观察现象 | 氯化钠固体溶解 | 说明氯化钠溶液 不是饱和溶液 |
探究实验二:将不饱和氯化钠溶液变为饱和溶液并探究饱和氯化钠溶液还能否溶解硝酸钾
实验步骤 | 实验现象 | 实验结论 |
向不饱和的氯化钠溶液 中不断加入氯化钠固体 | 有固体不再溶解 | NaCl不饱和溶液 变为饱和溶液 |
向饱和的氯化钠溶液中 加入少量的硝酸钾固体 | 硝酸钾固体溶解 | 饱和的氯化钠溶 液能溶解硝酸钾 |
【解析】
试题分析:①由于“碳酸氢钠不稳定,受热至65 ℃ 以上迅速分解,270 ℃ 时完全分解为碳酸钠”。所以加热一段时间后,碳酸钠没有分解,而碳酸氢钠分分解生成二氧化碳气体,可使澄清的石灰水变浑浊。因此会观察到: a中石灰水不变浑浊,b中石灰水变浑浊;由此可得出的结论是:小苏打易分解,苏打不易分解
![]() ②由题意可知:碳酸氢钠分解会生成碳酸钠和二氧化碳,结合元素种类在反应前后不变可知,生成物还应有含氢元素的水。所以化学反应方程式为:2 NaHCO3 Na2CO3+ H2O+CO2↑
②由题意可知:碳酸氢钠分解会生成碳酸钠和二氧化碳,结合元素种类在反应前后不变可知,生成物还应有含氢元素的水。所以化学反应方程式为:2 NaHCO3 Na2CO3+ H2O+CO2↑
③该装置可通过同等条件下是否反应来对比这两种物质是否能够分解;
④实验中应注意的问题是装置的气密性要良好、温度不能高于270 ℃等。
(2)探究实验一:当用药匙向5 mL氯化钠溶液中加入少量氯化钠固体,观察氯化钠固体溶解。说明原溶液还可继续溶解氯化钠,所以说明氯化钠溶液不是饱和溶液。
探究实验二:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液。所以应将向不饱和的氯化钠溶液中不断加入氯化钠固体;当观察到有“固体不再溶解”时,可说明不饱和氯化钠溶液变为饱和溶液。
饱和的氯化钠溶液只是在上述条件下不能再溶解氯化钠,还可以再溶解硝酸钾。所以实验方法应为:向饱和的氯化钠溶液中加入少量的硝酸钾固体。实验现象为:硝酸钾固体溶解。而实验实验结论为:饱和的氯化钠溶液能溶解硝酸钾实。