题目内容
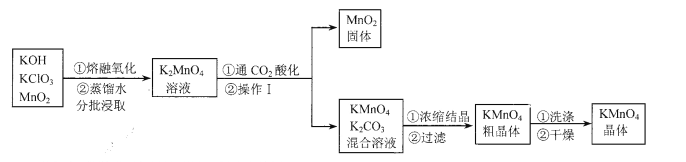
【题目】(5分)工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:
已知相关物质的溶解度(20℃)如下表:

(1)KMnO4中锰元素的化合价为 。
(2)操作I的名称是 。“干燥”过程中温度不宜过高的原因是 (用化学方程式表示)。
(3)“通CO2酸化”,反应的化学方程式为:
3K2 MNO4+2CO2======2KmnO4+MnO2↓+2K2 CO3
著用稀H2SO4酸化,反应的化学方程式为:
3K2 MNO4+2H2 SO4=====2KMnO4 +MnO2↓+2K2SO4+2H2O
工业上不采用稀H2SO4酸化的原因是 。
(4)电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为:
![]()
与“通CO2酸化”相比,其优点是 。
【答案】(1)+7 (2)过滤;2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)过程中产生的K2SO4的溶解度和高锰酸钾的差别不大,不易分离
(4)转化率高,没有造成锰元素的损失。
【解析】
试题分析:设KMnO4中锰元素的化合价为X,则+1+X+(-2)×4=0,X=+7;操作I的过程中能够得到固体和液体的分离所以名称是过滤;“干燥”过程中温度不宜过高的原因是高锰酸钾会受热分解;工业上不采用稀H2SO4酸化的原因是生成的K2SO4的溶解度和高锰酸钾的溶解度差别很小,不易分离。与“通CO2酸化”相比,其优点是转化率高,没有造成锰元素的损失。

练习册系列答案
相关题目