题目内容
【题目】过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:
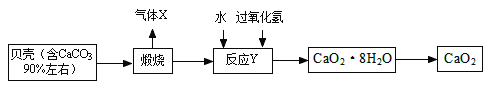
(1)气体X是CO2,其名称是 ;将过氧化钙晶体与溶液分离的方法是 。
(2)反应Y需控制温度在0~5℃,可将反应容器放在 中,该反应是化合反应,反应产物是CaO2·8H2O,请写出化学方程式 。获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 。
(3)CaO2的相对分子质量为 ,过氧化钙晶体﹝CaO2·8H2O﹞中H、O元素的质量比为 。
(4)为测定制得的过氧化钙晶体中CaO2·8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220℃充分反应(方程式为2CaO2·8H2O![]() 2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。
2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。
【答案】(1)二氧化碳;过滤(2)冰水混合物;CaO2+H2O2+7H2O=CaO2·8H2O; CaO或Ca(OH)2过量,且Ca(OH)2微溶;(3)72; 1∶10;(4)86.4%
【解析】
试题分析:(1)因为碳酸钙煅烧生成氧化钙和二氧化碳,故气体X为二氧化碳;固液分离为过滤操作;(2)反应Y需控制温度在0~5℃,可将反应容器放在冰水混合物中,反应的方程式为CaO2+H2O2+7H2O=CaO2·8H2O;获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是CaO或Ca(OH)2过量,且Ca(OH)2微溶;(3)CaO2的相对分子质量为72;过氧化钙晶体﹝CaO2·8H2O﹞中H、O元素的质量比为1∶10;
(4)解:设样品中CaO2·8H2O的质量为x
2CaO2·8H2O![]() 2CaO+O2↑+16H2O↑
2CaO+O2↑+16H2O↑
432 32
x 3.2
![]()
∴x=43.2(g)
∴样品中CaO2·8H2O的质量分数为![]() =86.4%
=86.4%
答:样品中CaO2·8H2O的质量分数为86.4%

 名校课堂系列答案
名校课堂系列答案【题目】
[查阅资料]有些水果、蔬菜对过氧化氢的分解有催化作用。
[实验探究1]探究苹果和土豆对过氧化氢分解是否有催化作用及催化效果:
各量取6ml的过氧化氢溶液,分别倒入1、2、3号三志试管中,取大小、形状基本相同的苹果块和土豆块,分别放入2、3号试管中,并把带火星的木条分别同时伸入三支试管口内,观察现象并记录如下:
试管编号 | 1 | 2 | 3 | |
材料名称 | 无 | 苹果 | 土豆 | |
实验现象 | 反应速率 | 很慢 | 稍快 | 较快 |
产生气泡 | 很少 | 比1中多 | 较多 | |
复燃情况 | 不复燃 | 复燃 | 很快复燃 | |
实验结论 | ||||
[实验探究2]探究浓度对过氧化氢分解速率的影响:
取10ml30%的过氧化氢三份,将其中两份分别稀释为不同浓度的溶液,同时测定收集到100ml氧气所用的时间,(其它实验条件均相同)记录如下:
实验编号 | 1 | 2 | 3 |
过氧化氢溶液浓度 | 5% | 15% | 30% |
所用时间(秒) | 205 | 25 | 3 |
实验结论 | |||
[实验条件3]用上述收集的仪器与不同位置进行反应,其中有一固体能在氧气中燃烧,发出明亮的蓝紫色火焰,生成刺激性气味的气体,该反应的化学方程式为: 。